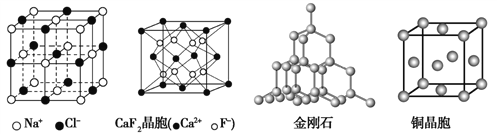
题目内容
【题目】I.实验室需要490 mL 0.1 mol·L—1 Na2CO3溶液,现用Na2CO3固体配制,请回答下列问题:
(1)配制所用的玻璃仪器有__________________________________________________________ ,用托盘天平称取Na2CO3____________g,
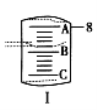
(2)如图Ⅰ表示10 mL量筒中液面的位置,A与C刻度间相差1 mL,如果刻度A为8,量筒中液体的体积是____________mL。
(3)实验中出现下列情况,对配制溶液的浓度有何影响?(填“偏高”、“偏低”或“无影响”)
A.定容前容量瓶底部有水珠____________;
B.定容时加水超过刻度线____________;
C.最终定容时仰视观察液面____________。
II.如果实验室用98%的浓硫酸(密度约为1.8g·cm-3 ) 配制1.8 mol·L-1的稀硫酸250mL。计算用量简量取所需浓硫酸的体积为____________mL。
【答案】 烧杯 玻璃棒 500mL容量瓶 胶头滴管 5.3 7.6 无影响 偏低 偏低 25
【解析】I.实验室需要490 mL 0.1 mol·L—1 Na2CO3溶液,现用Na2CO3固体配制。
(1)由于无490mL容量瓶,故选用500mL的容量瓶,故应配制0.1mol·L-1的Na2CO3溶液500mL,需要Na2CO3的质量为:0.5L×0.1mol·L-1×106g·mol-1=5.3g.配制顺序是:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签,一般用天平称量(用到药匙)称量5.3gNa2CO3,在烧杯中溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀.所以需要的仪器有托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管.配制所用的玻璃仪器有烧杯玻璃棒 500mL容量瓶胶头滴管;(2)由图知量筒A与C之间有10个小格,所以一个小格代表0.1ml,即此量筒的分度值为0.1ml,如果刻度A为8,则刻度C为7,凹液面最低处与7.5mL以上一个刻度处相平,所以液体体积为7.6mL;(3)A、定容前容量瓶底部有水珠,只要最后定容时凹液面与刻度线相切即可,至于水是事先就有的还是后来加入的,对浓度无影响;B、定容时加水超过刻度线,则溶液体积偏大,浓度偏低;C、最终定容时仰视观察液面,则导致溶液体积偏大,则浓度偏低。II.98%的浓硫酸(密度为1.8g·cm-3)的物质的量浓度C=![]() =18mol·L-1,设需要浓硫酸体积为V,依据溶液稀释规律可得:V×18mol·L-1=1.8mol·L-1×250ml,解得:V=25.0ml;
=18mol·L-1,设需要浓硫酸体积为V,依据溶液稀释规律可得:V×18mol·L-1=1.8mol·L-1×250ml,解得:V=25.0ml;

 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案