题目内容
(8分)在25℃时,用石墨电极电解100mL,1 mol?L-1AgNO3溶液。如有0.2mol电子发生转移,试回答下列问题:
(1)阴极上发生的电极反应为 ;
(2)电解后溶液中溶质的物质的量浓度为 (假设溶液的体积不变);
(3)计算电解产生的气体的总体积(标准状况)。
(1)Ag++e-  Ag,2H++2e-
Ag,2H++2e- ![]() H2↑(2分,各1分)
H2↑(2分,各1分)
(2)1mol?L-1(2分)
(3)4OH- 2H2O+O2↑+4e
2H2O+O2↑+4e
n(O2)=![]() ×0.2mol = 0.05mol(1分)
×0.2mol = 0.05mol(1分)
Ag+放电转移电子:1mol?L-1×0.1L=0.1mol
H+放电转移电子:0.2mol-0.1mol=0.1mol(1分)
n(H2)=![]() ×0.1mol=0.05mol(1分)
×0.1mol=0.05mol(1分)
气体总体积:(0.05mol+0.05mol)×22.4L?mol-1=2.24L(1分)

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
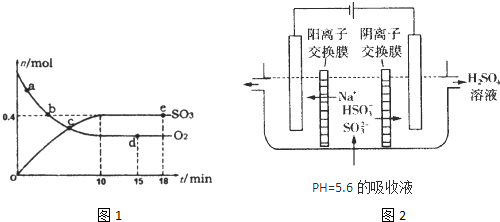
 Pa下,容积为1.0L的密闭容器中充入0.5molSO2,
(g)和0.3 molO2 (g),发生反应2SO2(g)+O2(g)
Pa下,容积为1.0L的密闭容器中充入0.5molSO2,
(g)和0.3 molO2 (g),发生反应2SO2(g)+O2(g) 2SO3(g)
△H=-198kJ/mol。反应中n(SO3)和n(O2)随时间变化的关系如右图所示
2SO3(g)
△H=-198kJ/mol。反应中n(SO3)和n(O2)随时间变化的关系如右图所示 。反应的平衡常数K=_______;0到10 min内用SO2表示的平均反应速率_________。根据图中信息,判断下列叙述中正确的是_____(填序号)。
。反应的平衡常数K=_______;0到10 min内用SO2表示的平均反应速率_________。根据图中信息,判断下列叙述中正确的是_____(填序号)。