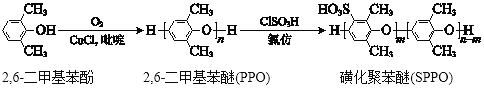
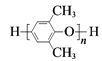
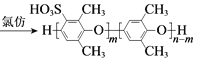
题目内容
【题目】将0.1 mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体时都会引起( )
A. CH3COOH电离程度变大 B. 溶液pH减小 C. 溶液的导电能力减弱 D. 溶液中c(H+)减小
【答案】D
【解析】
A、在CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+。当加水稀释时,c(CH3COOH)、c(CH3COO-)、c(H+)都减小,电离平衡正向移动,CH3COOH电离的百分率变大,加入CH3COONa晶体抑制酸的电离,所以溶液中CH3COOH电离的百分率变小,A错误;
CH3COO-+H+。当加水稀释时,c(CH3COOH)、c(CH3COO-)、c(H+)都减小,电离平衡正向移动,CH3COOH电离的百分率变大,加入CH3COONa晶体抑制酸的电离,所以溶液中CH3COOH电离的百分率变小,A错误;
B、加水稀释,电离平衡正向移动,但是稀释作用大于平衡正向移动使离子浓度增大的趋势,所以溶液的pH增大;盐电离产生的CH3COO-使c(CH3COO-)增大,电离平衡CH3COOH![]() CH3COO-+H+向逆向移动,c(CH3COOH)、c(H+)都减小。c(H+)越小,溶液的pH增大,B错误;
CH3COO-+H+向逆向移动,c(CH3COOH)、c(H+)都减小。c(H+)越小,溶液的pH增大,B错误;
C、稀释溶液中氢离子浓度减小,溶液的导电能力减弱;当加入少量CH3COONa晶体时,溶液中自由移动的离子浓度增大,所以溶液的导电性增强,C错误;
D、根据以上分析可知将0.1 mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起溶液的pH增大,D正确。
答案选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】研究生铁的锈蚀,下列分析不正确的是
序号 | ① | ② | ③ |
实验 |
|
|
|
现象 | 8小时未观察 到明显锈蚀 | 8小时未观察 到明显锈蚀 | 1小时观察 到明显锈蚀 |
A. ①中,NaCl溶液中溶解的O2不足以使生铁片明显锈蚀
B. ②中,生铁片未明显锈蚀的原因之一是缺少H2O
C. ③中正极反应:O2+4e+ 2H2O ==4OH
D. 对比①②③,说明苯能隔绝O2