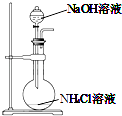
题目内容
【题目】25℃时,溶液均为0.1mol/L的溶液,其pH如表所示,下列有关说法正确的是( )
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH4COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A.酸性强弱:H2CO3>HF
B.①和②中溶质均未水解
C.离子的总浓度:①>③
D.④中:c(HCO ![]() )+2c(CO
)+2c(CO ![]() )+c(H2CO3)=0.1mol/L
)+c(H2CO3)=0.1mol/L
【答案】C
【解析】解:A、依据盐溶液的PH判断溶液酸碱性,NaF和NaHCO3溶液中阴离子水解显碱性,对应酸性越弱,阴离子水解程度越强,碳酸氢钠溶液PH大于NaF溶液PH,则对应酸性,H2CO3<HF,故A错误;B、氯化钠溶液是强酸强碱溶液,溶液PH=7,溶液不水解,醋酸铵溶液是弱酸弱碱盐,溶液PH=7,说明醋酸根离子和铵根离子水解程度相同,溶液显中性,①和溶质未水解,②中溶质发生双水解,故B错误;
C、氯化钠溶液是强酸强碱溶液不水解,溶液中氢离子浓度等于氢氧根离子浓度,NaF溶液中氟离子水解破坏了水的电离,溶液中氢氧根离子浓度大于氢离子浓度,溶液中电荷守恒c(Na+)+c(H+)=c(OH﹣)+c(Cl﹣),溶液呈中性得到c(Na+)=c(Cl﹣),c(Na+)+c(H+)=c(OH﹣)+c(F﹣),溶液呈碱性,c(H+)<c(OH﹣),得到c(Na+)>c(F﹣),离子的总浓度:①>③,故C正确;
D、依据碳酸氢钠溶液中存在物料守恒,碳元素物质的量总量不变,④中物料守恒:c(HCO ![]() )+c(CO
)+c(CO ![]() )+c(H2CO3)=0.1mol/L,故D错误,
)+c(H2CO3)=0.1mol/L,故D错误,
故选C.
A、分析盐溶液的PH判断溶液酸碱性,NaF和NaHCO3溶液中阴离子水解显碱性,对应酸性越弱,阴离子水解程度越强;
B、氯化钠溶液是强酸强碱溶液不水解,醋酸铵溶液是弱酸弱碱盐,醋酸根离子和铵根离子水解程度相同,溶液显中性;
C、氯化钠溶液是强酸强碱溶液不水解,溶液中氢离子浓度等于氢氧根离子浓度,NaF溶液中氟离子水解破坏了水的电离,溶液中氢氧根离子浓度大于氢离子浓度,结合溶液中电荷守恒比较大小;
D、依据碳酸氢钠溶液中存在物料守恒,碳元素物质的量总量不变;

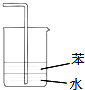
【题目】已知甲和乙的某些性质如下表所示:
物质 | 熔点(℃) | 沸点(℃) | 密度(g/mL) | 水中的溶解性 |
甲 | -98 | 37.5 | 0.93 | 可溶 |
乙 | -48 | 95 | 0.90 | 可溶 |
现有甲和乙的混合物,进行分离时,可采用的方法是( )
A. 蒸发B. 过滤C. 蒸馏D. 萃取
【题目】下表各组物质分类不正确的是( )
选项 | A | B | C | D |
物质 | 液氧、空气、Cl2、铜丝 | HCl、H2SO4、H2O、HNO3 | NaCl溶液、盐酸、CuSO4·5H2O | NH3、NaOH、BaSO4固体 |
分类标准 | 单质 | 酸 | 混合物 | 电解质 |
不属于该 类的物质 | 空气 | H2O | 盐酸 | NH3 |
A. A B. B C. C D. D