题目内容
(2012?长宁区一模)向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
|
分析:A.加热至170℃,可产生具有还原性的二氧化硫气体;
B.呈紫色说明有I2生成;
C.NaHCO3比Na2CO3溶解度小;
D.氨气易溶于水,加入稀NaOH溶液,难以挥发出氨气.
B.呈紫色说明有I2生成;
C.NaHCO3比Na2CO3溶解度小;
D.氨气易溶于水,加入稀NaOH溶液,难以挥发出氨气.
解答:解:A.浓硫酸具有脱水性和强氧化性,生成乙烯的同时可生成二氧化硫气体,也可使酸性高锰酸钾溶液褪色,故A错误;
B.呈紫色说明有I2生成,说明I-被氯水氧化,故B正确;
C.NaHCO3比Na2CO3溶解度小,向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊,可说明生成NaHCO3,故C正确;
D.氨气易溶于水,加入稀NaOH溶液,难以挥发出氨气,应用浓NaOH溶液或加热才可生成氨气,故D错误.
故选BC.
B.呈紫色说明有I2生成,说明I-被氯水氧化,故B正确;
C.NaHCO3比Na2CO3溶解度小,向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊,可说明生成NaHCO3,故C正确;
D.氨气易溶于水,加入稀NaOH溶液,难以挥发出氨气,应用浓NaOH溶液或加热才可生成氨气,故D错误.
故选BC.
点评:本题综合考查物质的检验和鉴别的实验设计,题目难度不大,注意浓硫酸的性质,把握物质的检验方法,牢固掌握物质的性质为解答该类题目的关键之处.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
 (2012?长宁区一模)将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘少.下列说法正确的是( )
(2012?长宁区一模)将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘少.下列说法正确的是( )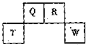 (2012?长宁区一模)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(2012?长宁区一模)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
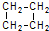
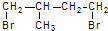
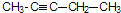

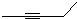
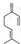 的分子式为
的分子式为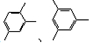
 以及必要的无机试剂可合成
以及必要的无机试剂可合成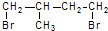 ,写出第一步合成反应的化学方程式
,写出第一步合成反应的化学方程式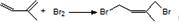
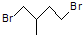
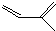
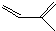 的一种同分异构体A,它的一氯代物有三种.与Br2按1:1加成产物只有一种(不考虑顺反、立体异构),则A的结构简式为
的一种同分异构体A,它的一氯代物有三种.与Br2按1:1加成产物只有一种(不考虑顺反、立体异构),则A的结构简式为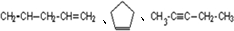
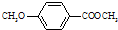
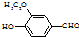 )是食品添加剂的增香原料,其香味比香草醛更加浓郁.
)是食品添加剂的增香原料,其香味比香草醛更加浓郁.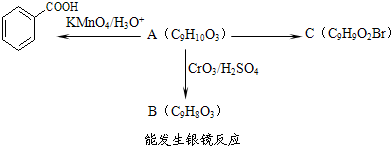
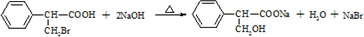
 )是一种医药中间体.
)是一种医药中间体.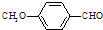 )合成D.用反应流程图表示如下,请将后面一步的反应条件写在箭号下方,试剂或原料写在箭号上方,中间产物填在下图中的方框内.并写出茴香醛与银氨溶液反应的化学方程式.
)合成D.用反应流程图表示如下,请将后面一步的反应条件写在箭号下方,试剂或原料写在箭号上方,中间产物填在下图中的方框内.并写出茴香醛与银氨溶液反应的化学方程式.
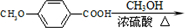
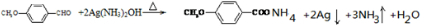
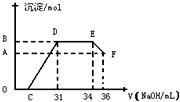 (2012?长宁区一模)Ⅰ将a mol的Na2O2和bmol NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应,假设NaHCO3分解产生的CO2与Na2O2反应完后,H2O再与Na2O2反应.
(2012?长宁区一模)Ⅰ将a mol的Na2O2和bmol NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应,假设NaHCO3分解产生的CO2与Na2O2反应完后,H2O再与Na2O2反应.