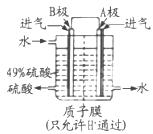
题目内容
0.02 mol FeS2与一定浓度的硝酸完全反应,Fe元素和S元素全部转化为 和
和 ,同
,同
时产生氮的氧化物(NO、NO2、N2O4)混合气体共0.25 mol,该混合气体的平均相对分子质量可能是
 和
和 ,同
,同时产生氮的氧化物(NO、NO2、N2O4)混合气体共0.25 mol,该混合气体的平均相对分子质量可能是
| A.30 | B.46 | C.50 | D.66 |
BC
试题分析:根据电子守恒,0.02 mol FeS2,失电子总数:0.02*(1+14)=0.3mol,若产物全是NO,则为0.1mol,不可能。若产物全是NO2,物质的量为0.3mol这与混合气体共0.25 mol不符,不可能。若产物全是N2O4,物质的量为0.15mol这与混合气体共0.25 mol不符,不可能。所以产生气体的相对分子质量应该在(NO,NO2)和(NO2,N2O4)两种情况之间。若为(NO,NO2),设两者物质的量分别为:x,y,则有x+y="0.25,3x+y=0.3,x=0.025" y=0.225,求得M=(0.025*30+46*0.225)/0.25=44.4。若为(NO2,N2O4),设两者物质的量分别为:x,y,则有x+y="0.25,x+2y=0.3,x=0.2" y=0.05,求得M=(0.05*92+46*0.2)/0.25=55.2。即相对分子质量在44.4--55.2之间,故选BC。

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目


 2SO3,在一密闭容器中一定时间内达到平衡。
2SO3,在一密闭容器中一定时间内达到平衡。