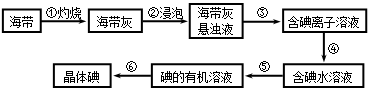
题目内容
溴化锂常用于制冷工业,可用尿素、碳酸锂及溴为原料生产溴化锂,其原理是
3Br2+3Li2CO3+CO(NH2)2 6LiBr+2H2O+N2↑+4CO2↑其主要工艺流程如下:
6LiBr+2H2O+N2↑+4CO2↑其主要工艺流程如下:
(1)溴化时,pH过小对反应不利,一方面是因为碳酸锂会反应生成_____________,另一方面使溴单质和水的反应平衡向_______移动,温度不宜超过60℃的原因是_______。
(2)反应过程中,若pH>6,产品中会有溴酸盐,其原因是BrO-发生了自身的氧化还原反应,写出反应的离子方程式:________________。
(3)试剂X的化学式为_____________,加活性炭处理的目的是________________。
(4)若直接用氨水代替尿素也可生产溴化锂,同时生成水、二氧化碳和氮气,该反应的化学方程式为_________________。
(5)用惰性电极电解熔融碳酸锂可得到金属锂,则阳极的电极方程式为______________。
(6)若原料中碳酸锂的质量为mg,最终得到溴化锂的质量为ng,据此能不能计算出溴化锂的产率?若能请写出其表达式(含m、n的表达式);若不能,请说明理由______________。
(1)二氧化碳 (1分)逆反应方向(1分) 温度过高会加快溴蒸汽的挥发或次溴酸根会发生自身氧化还原反应(2分)
(2)3BrO- BrO3- +2 Br- (2分)
BrO3- +2 Br- (2分)
(3)LiOH (1分)吸附脱色(1分)
(4)3 Br2+3 Li2CO3+2 NH3.H2O="6" LiBr+5 H2O+N2↑+3 CO2↑ (3分)
(5)2 CO32-- 4 e-=O2↑+2CO2↑ (2分)
(6)不能,因为在图示流程中加入的 LiOH也会生成LiBr (2分)
解析试题分析:(1)溴化时,pH过小,酸性大,碳酸锂会反应生成CO2,另一方面使溴单质和水的反应Br2+H2O H++Br-+HBrO平衡向逆反应方向移动;温度过高会加快溴蒸汽的挥发和次溴酸根会发生自身氧化还原反应,所以温度不宜超过60℃。
H++Br-+HBrO平衡向逆反应方向移动;温度过高会加快溴蒸汽的挥发和次溴酸根会发生自身氧化还原反应,所以温度不宜超过60℃。
(2) BrO-发生了自身的氧化还原反应是Br元素化合价升高和降低:3BrO- BrO3- +2 Br-。
BrO3- +2 Br-。
(3)调节pH溶液时不增加新杂质,阳离子是Li+,故碱是LiOH;活性炭用于吸附脱色。
(4)题干信息“氨水代替尿素也可生产溴化锂,同时生成水、二氧化碳和氮气”,不难写出3 Br2+3 Li2CO3+2 NH3.H2O="6" LiBr+5 H2O+N2↑+3 CO2↑。
(5) 用惰性电极电解熔融碳酸锂可得到金属锂,阳极阴离子CO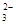 放电,电极方程式为2 CO
放电,电极方程式为2 CO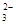 -4 e-=O2↑+2CO2↑。
-4 e-=O2↑+2CO2↑。
(6) 若原料中碳酸锂的质量为mg,最终得到溴化锂的质量为ng,因为在图示流程中加入的 LiOH也会生成LiBr,据此不能计算出溴化锂的产率。
考点:化学与技术。考查工艺流程中的反应条件选择、反应的方程式、电解原理等。

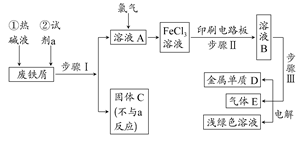
下图中a、b、c表示相应仪器中加入的试剂,可用下图装置制取、净化、收集的气体是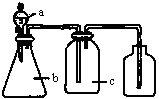
| 编号 | 气体 | a | b | c |
| A | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| B | CO2 | 盐酸 | 碳酸钙 | 饱和NaHCO3 |
| C | NO | 稀硝酸 | 铜屑 | H2O |
| D | NO2 | 浓硝酸 | 铜屑 | NaOH溶液 |
暗紫色化合物A具有绿色、高电压和高能量的特点,近年来引起了电化学界的高度重视。在常温和干燥的条件下,化合物A可以稳定的存在,但它在水溶液中不稳定,一段时间后转化为红褐色沉淀,同时产生一种气体单质。某兴趣小组的同学对化合物A进行组成分析,确定A中仅含有O、K、Fe三种元素。取3.96g化合物A的粉末溶于水,滴加足量的稀硫酸,向反应后的溶液中加入含有0.08mol KOH的溶液,恰好完全反应。过滤,将洗涤后的沉淀充分灼烧,得到红棕色固体粉末1.60g;将所得滤液在一定条件下蒸发可得到一种纯净的不含结晶水的盐10.44g。
(1)化合物A的化学式为 ;化合物A与H2O反应的离子方程式为 。
(2)化合物A还可作为一种“绿色高效多功能”水处理剂。原因是 。
(3)化合物A的制备还可通过氧化法,试写出在KOH存在条件下用次氯酸钾氧化氢氧化铁制备A的化学方程式 。
(4)目前,人们针对化合物A的稳定性进行了大量的探索,并取得了一定的进展。下列物质中有可能提高化合物A水溶液稳定性的是
| A.亚硫酸钠 | B.KOH | C.醋酸 | D.Fe(NO3)3 |
 易升华。工业上制备无水的
易升华。工业上制备无水的
 Fe2++Cr3+,则电池放电时,Cl-将移向 极(填“正”或“负”);充电时,阴极的电极反应式为 。
Fe2++Cr3+,则电池放电时,Cl-将移向 极(填“正”或“负”);充电时,阴极的电极反应式为 。


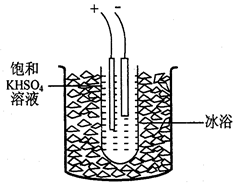
 I2+I-;2S2O32-+I2=2I- + S4O62-)
I2+I-;2S2O32-+I2=2I- + S4O62-)