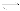ƒøƒ⁄»ð
¢Ò£Æœ÷¥˙𧓵≥£“‘¬»ªØƒ∆Œ™‘≠¡œ÷∆±∏¥øºÓ£¨≤ø∑÷𧓒¡˜≥ûÁœ¬£∫
“—÷™NaHCO3‘⁄µÕŒ¬œ¬»ÐΩ‚∂»Ωœ–°°£
∑¥”¶¢Ò£∫NaCl+CO2+NH3+H2O NaHCO3°˝+NH4Cl£¨¥¶¿Ìƒ∏“∫µƒ¡Ω÷÷∑Ω∑®£∫
NaHCO3°˝+NH4Cl£¨¥¶¿Ìƒ∏“∫µƒ¡Ω÷÷∑Ω∑®£∫
£®1£©œÚƒ∏“∫÷–º”»Î ت“»È£¨ø…Ω´∆‰÷–________—≠ª∑¿˚”√°£
£®2£©œÚƒ∏“∫÷–Õ®»ÎNH3£¨º”»Îœ∏–°µƒ ≥—Œø≈¡£≤¢ΩµŒ¬£¨ø…µ√µΩNH4Clæß𣠑–¥≥ˆÕ®»ÎNH3∫Û£¨»ÐΩ‚∂»Ωœ–°µƒÀ· ΩúÀ·—Œ◊™±‰Œ™»ÐΩ‚∂»Ωœ¥ÛµƒÃºÀ·—Œµƒ¿Î◊”∑Ω≥Ã Ω ___________°£
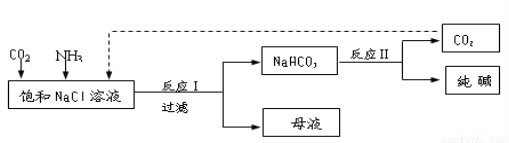
¢Ú£Æƒ≥ªØ—ß–°◊ȃ£ƒ‚°∞∫Ó œ÷∆ºÓ∑®°±£¨“‘NaCl°¢NH3°¢CO2∫ÕÀƵ»Œ™‘≠¡œ“‘º∞œ¬ÕºÀ˘ æ◊∞÷√÷∆»°NaHCO3£¨»ª∫Û‘ŸΩ´NaHCO3÷∆≥…Na2CO3°£
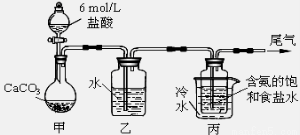
£®1£©◊∞÷√±˚÷–¿‰ÀƵƒ◊˜”√ « £ª
£®2£©”…◊∞÷√±˚÷–≤˙…˙µƒNaHCO3÷∆»°Na2CO3 ±£¨–Ë“™Ω¯––µƒ µ—È≤Ÿ◊˜”–_______°¢œ¥µ”°¢◊∆…’°£NaHCO3◊™ªØŒ™Na2CO3µƒªØ—ß∑Ω≥Ã ΩŒ™ £ª
£®3£©»Ù‘⁄£®2£©÷–◊∆…’µƒ ±º‰Ωœ∂ã¨NaHCO3Ω´∑÷Ω‚≤ªÕÍ»´£¨∏√–°◊È∂‘“ª∑𺔻»¡Àt1 minµƒNaHCO3 —˘∆∑µƒ◊È≥…Ω¯––¡À“‘œ¬ÃΩæø°£
»°º”»»¡Àt1 minµƒNaHCO3—˘∆∑29£Æ6 gÕÍ»´»Ð”⁄ÀÆ÷∆≥…»Ð“∫£¨»ª∫ۜڥÀ»Ð“∫÷–ª∫¬˝µÿµŒº”œ°—ŒÀ·£¨≤¢≤ª∂œΩ¡∞Ë°£ÀÊ◊≈—ŒÀ·µƒº”»Î£¨»Ð“∫÷–”–πÿ¿Î◊”µƒŒÔ÷ µƒ¡øµƒ±‰ªØ»ÁÕºÀ˘ æ°£
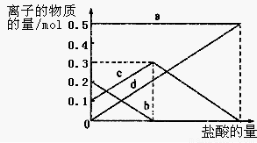
‘Ú«˙œþa∂‘”¶µƒ»Ð“∫÷–µƒ¿Î◊” «___________£®ÃÓ¿Î◊”∑˚∫≈œ¬Õ¨£©£ª«˙œþc∂‘”¶µƒ»Ð“∫÷–µƒ¿Î◊” «___________£ª∏√—˘∆∑÷–NaHCO3∫ÕNa2CO3µƒŒÔ÷ µƒ¡ø÷Ʊ» « £ª 21
£®4£©»Ù»°21£Æ0 g NaHCO3πÃ㨺”»»¡Àt2 rnin∫Û£¨ £”ýπÃõƒ÷ ¡øŒ™l4£Æ8 g°£»Áπ˚∞—¥À £”ýπÃû´≤øº”»ÎµΩ200 mL 2 mol?L°™1µƒ—ŒÀ·÷–£¨‘Ú≥‰∑÷∑¥”¶∫ۻГ∫÷–H+ µƒŒÔ÷ µƒ¡ø≈®∂»Œ™____________£®…˻Г∫ê˝±‰ªØ∫ˆ¬‘≤ªº∆£©
¢Ò£®1£©NH3
£®2£©HCO3®C+NH3=NH4++CO32®C
¢Ú£Æ£®1£©¿‰»¥£¨ πúÀ·«‚ƒ∆æßÃÂŒˆ≥ˆ
£®2£©π˝¬À 2NaHCO3 Na2CO3+H2O+CO2°¸
Na2CO3+H2O+CO2°¸
£®3£©Na+ HCO3- 1:2
£®4£©0£Æ75 mol/L
°æΩ‚Œˆ°ø
‘Â∑÷Œˆ£∫¢Ò£®1£©œÚ∑÷¿Î≥ˆNaHCO3æßÃÂ∫Ûµƒƒ∏“∫NH4Cl÷–º”»Îπ˝¡ø ت“»È£¨∑¢…˙µƒ∑¥”¶”–Ca£®OH£©2+2NH4Cl=2NH3°¸+2H2O+CaCl2£¨◊Ó÷’≤˙ŒÔŒ™¬»ªØ∏∆°¢∞±∆¯£¨∆‰÷–∞±∆¯ø…‘Ÿ¿˚”√£¨π ¥∞∏Œ™£∫NH3£ª
£®2£©Õ®»ÎNH3∫Û£¨»ÐΩ‚∂»Ωœ–°µƒÀ· ΩúÀ·—Œ◊™±‰Œ™»ÐΩ‚∂»Ωœ¥ÛµƒÃºÀ·—Œµƒ¿Î◊”∑Ω≥à ΩHCO3®C+NH3=NH4++CO32®C°£
¢Ú£Æ£®1£©◊∞÷√±˚÷–¿‰ÀƵƒ◊˜”√ «ΩµŒ¬£¨ πúÀ·«‚ƒ∆æßÃÂŒˆ≥ˆ°£
£®2£©”…◊∞÷√±˚÷–≤˙…˙µƒNaHCO3∑¢…˙µƒ∑¥”¶Œ™£¨NH3+CO2+H2O+NaCl=NaHCO3°˝+NH4Cl£ª÷∆»°Na2CO3 ±–Ë“™π˝¬Àµ√µΩæß㨜¥µ”∫Ûº”»»◊∆…’µ√µΩúÀ·ƒ∆£ª2NaHCO3 Na2CO3+H2O+CO2°¸
Na2CO3+H2O+CO2°¸
£®3£©»Ð“∫÷–”–πÿ¿Î◊”µƒŒÔ÷ µƒ¡øµƒ±‰ªØŒ™£∫ƒ∆¿Î◊” º÷’≤ª±‰£¨ÃºÀ·∏˘¿Î◊”ºı–°£¨ÃºÀ·«‚∏˘¿Î◊”≈®∂»‘ˆ¥Û£¨µ±ÃºÀ·∏˘¿Î◊”»´≤ø◊™ªØŒ™ÃºÀ·«‚∏˘¿Î◊”£¨‘ŸµŒ»Î—ŒÀ·∫ÕúÀ·«‚∏˘¿Î◊”∑¥”¶…˙≥…∂˛—ıªØú£¨ÃºÀ·«‚∏˘¿Î◊”ºı–°£¨À˘“‘c«˙œþ±Ì 浃 «ÃºÀ·«‚∏˘¿Î◊”≈®∂»±‰ªØ£ªÃºÀ·∏˘¿Î◊”≈®∂»0£Æ2mol/L£ªÃºÀ·«‚∏˘¿Î◊”≈®∂»Œ™0£Æ1mol/L£ª—˘∆∑÷–NaHCO3∫ÕNa2CO3µƒŒÔ÷ µƒ¡ø÷Ʊ» «1£∫2£ª π ¥∞∏Œ™£∫Na+ £¨HCO3-£ª 1£∫2£ª
£®4£©»Ù»°21g NaHCO3πÃÃÂŒÔ÷ µƒ¡ø=21g/84g/mol=0£Æ25mol£¨
º”»»¡Àt1min∫Û£¨ £”ýπÃõƒ÷ ¡øŒ™14£Æ8g£Æ“¿æðªØ—ß∑Ω≥Ã Ω¥Ê‘⁄µƒ÷ ¡ø±‰ªØº∆À„£∫
2NaHCO3=Na2CO3+CO2°¸+H2O °˜m
2 1 62
0£Æ2mol 0£Æ1mol 21g-14£Æ8g
∑¥”¶∫ÛNaHCO3ŒÔ÷ µƒ¡ø=0£Æ25mol-0£Æ2mol=0£Æ05mol£ªNaHCO3+HCl=NaCl+H2O+CO2°¸£ªœ˚∫ƒ¬»ªØ«‚ŒÔ÷ µƒ¡ø0£Æ05mol£ª
Na2CO3ŒÔ÷ µƒ¡ø=0£Æ1mol£¨Na2CO3+2HCl=2NaCl+H2O+CO2°¸£¨œ˚∫ƒ¬»ªØ«‚ŒÔ÷ µƒ¡ø0£Æ2mol£ª
£”ý¬»ªØ«‚ŒÔ÷ µƒ¡ø=0£Æ200L°¡2mol/L-0£Æ05mol-0£Æ2mol=0£Æ15mol£¨ £”ý»Ð“∫÷–c£®H+£©=
0£Æ15mol/0£Æ2L=0£Æ75mol/Lπ ¥∞∏Œ™£∫0£Æ75mol/L
øºµ„£∫𧓵÷∆¥øºÓµƒ‘≠¿Ì∑÷Œˆ£¨…˙≤˙π˝≥Ã÷–µƒŒÔ÷ ±‰ªØ£¨ªÏ∫œŒÔ≥…∑÷µƒ∑÷Œˆ≈–∂œ∫ÕÕºœÛ∂®¡ø∑÷Œˆº∆À„”¶”√°£