题目内容
14.比较下列溶液的pH大小.(填“>”“<”或“=”)(1)100mL 20℃的水>10mL 100℃的水
(2)0.1mol/LNH4Cl溶液<0.01mol/LNH4Cl溶液
(3)0.1mol/LH2SO4溶液<0.01mol/LNaOH溶液
(4)0.1mol/LNa2CO3溶液>0.1mol/LNaHCO3溶液
(5)0.1mol/L(NH4)2CO3溶液<0.1mol/LNa2CO3溶液.
分析 (1)水的电离为吸热反应;
(2)相同温度下,不同浓度的氯化铵溶液,浓度越大其水解程度越小;
(3)酸溶液pH小于碱溶液pH值;
(4)碳酸根离子的第一步水解能力大于第二步水解能力;
(5)铵根离子和碳酸根离子相互促进水解.
解答 解:(1)水的电离为吸热反应,升高温度,水的电离平衡右移,氢离子浓度增大,pH值减小,故答案为:>;
(2)相同条件下,氯化铵的浓度越大,其水解程度越小,但浓度越大的氯化铵溶液中铵根离子水解的浓度大,所以0.1mol/LNH4Cl溶液的pH小于0.01mol/L NH4Cl溶液,故答案为:<;
(3)硫酸为酸,常温下pH小于7,氢氧化钠为碱,常温下pH大于7,故答案为:<;
(4)碳酸是二元弱酸,其第一步电离程度远远大于第二步电离程度,所以碳酸根离子的水解程度大于第二步水解程度,相同浓度的碳酸钠和碳酸氢钠,水解程度越大的其溶液的pH越大,所以0.1mol/LNa2CO3溶液大于0.1mol/L NaHCO3溶液,故答案为:>;
(5)铵根离子和碳酸根离子相互促进水解,铵根离子水解使溶液呈酸性,钠离子不水解,所以0.1mol/L(NH4)2CO3溶液碱性小于0.1mol/L Na2CO3溶液,故答案为:<.
点评 本题考查了溶液pH大小的判断,明确盐类水解的影响因素是解本题关键,知道酸的电离平衡常数与其酸根离子水解程度的关系,为易错点.

练习册系列答案
相关题目
2.下列物质中,属于合金的是( )
①不锈钢 ②生铁 ③青铜 ④水银 ⑤黄铜 ⑥硬铝 ⑦碳素钢 ⑧储氢合金.
①不锈钢 ②生铁 ③青铜 ④水银 ⑤黄铜 ⑥硬铝 ⑦碳素钢 ⑧储氢合金.
| A. | 全部 | B. | 除④以外 | C. | 除②④以外 | D. | 除④⑥以外 |
9.下列各组物质中,不属于同分异构体关系的是( )
| A. | 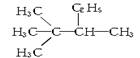 与 与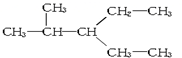 | B. | 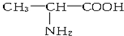 与CH3-CH2-CH2-NO2 与CH3-CH2-CH2-NO2 | ||
| C. | CH3COOCH2CH3与CH3CH2COOH | D. | C2H5-O-C2H5与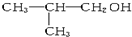 |
6.下列各组中两个变化所发生的反应,属于同一类型的是( )
| A. | 由甲苯制甲基环己烷、由乙烷制溴乙烷 | |
| B. | 乙烯使溴水褪色、乙炔使酸性高锰酸钾水溶液褪色 | |
| C. | 由乙烯制聚乙烯、由氯乙烯制聚氯乙烯 | |
| D. | 由苯制硝基苯、由溴乙烷制取乙醇 |
3.如图是4个碳原子相互结合的8种有机物(氢原子没有画出)A~H的碳架结构,下列说法正确的是( )

| A. | 有机物E的名称是异丙烷 | B. | B与C及D毒为同分异构体 | ||
| C. | F与G互为同系物 | D. | A与H实验式相同 |