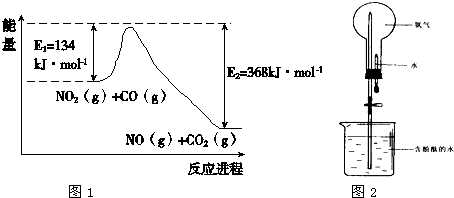
题目内容
|
将NO和CO2的混合气体20 mL缓缓通过足量的Na2O2时,剩余气体10 mL,则原混合气体的组成不可能是下列组中的(NO与Na2O2的反应不考虑,气体体积在相同状态下测定) | |
| [ ] | |
A. |
6 mL NO 14 mL CO2 |
B. |
8 mL NO 12 mL CO2 |
C. |
10 mL NO 10 mL CO2 |
D. |
12 mL NO 8 mL CO2 |
答案:D
解析:
解析:
|
假设原混合气体中含CO2 A mL,则NO为(20-A)mL,CO2与过氧化钠反应放出氧气A/2 mL.若NO过量,由反应方程式2NO+O2 |

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
|
将 20 mL NO和CO2的混合气体缓慢通过足量的Na2O2后,剩余气体的体积变为10 mL.则原混合气体的组成可能是(不考虑NO与Na2O2反应,气体体积在相同状态下测定)① 6 mL NO和14 mL CO2② 8 mL NO和12 mL CO2③ 10 mL NO和10 mL CO2④ 12 mL NO和8 mL CO2 | |
| [ ] | |
A. |
只有③ |
B. |
只有①② |
C. |
只有①②③ |
D. |
①②③④ |