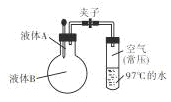
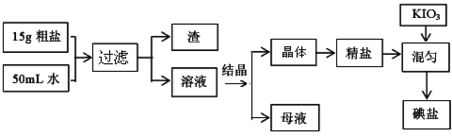
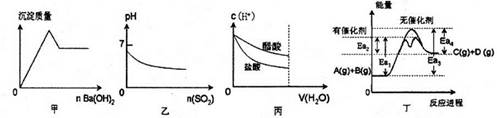
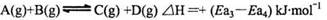题目内容
下述实验能达到预期目的的是
| 编号 | 实验内容 | 实验目的 |
| A | 取两只试管,分别加入4 mL 0.01 mol/L KMnO4酸性溶液,然后向一只试管中加入0.1 mol/L H2C2O4溶液 2 mL,向另一只试管中加入0.1 mol/L H2C2O4溶液 4 mL,记录褪色时间 | 证明草酸浓度越大反应速率越快 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| C | 向1mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下,溶解度Mg(OH)2 >Fe(OH)3 |
| D | 测定等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 | 证明非金属性S>C |
B
试题分析:A、两只试管中的KMnO4酸性溶液浓度不一样,因此无法证明草酸浓度越大反应速率越快,错误;B、对于水解反应CO2- 3+H2O
 HCO3-+OH–,加入少量BaC12固体,会消耗CO2- 3使平衡逆移,溶液碱性减弱,正确;C、证明在相同温度下,溶解度Mg(OH)2 <Fe(OH)3,错误;D、非金属性的大小,决定最高价含氧酸的酸性强弱,S的最高价为+6价,错误。
HCO3-+OH–,加入少量BaC12固体,会消耗CO2- 3使平衡逆移,溶液碱性减弱,正确;C、证明在相同温度下,溶解度Mg(OH)2 <Fe(OH)3,错误;D、非金属性的大小,决定最高价含氧酸的酸性强弱,S的最高价为+6价,错误。
练习册系列答案
相关题目