题目内容
【题目】为了测定某有机物A的结构,做如下实验:
①将2.3g该有机物完全燃烧,生成0.1molCO2和2.7g水;
②用质谱仪测定其相对分子质量,得到如图1所示的质谱图;
③用核磁共振仪处理该化合物,得到如图2所示图谱,图中三个峰的面积之比是1∶2∶3。
试回答下列问题:
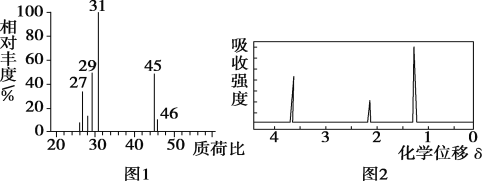
(1)有机物A的相对分子质量是__。
(2)写出有机物A的结构简式:__。
【答案】46 CH3CH2OH
【解析】
(1)在A的质谱图中,最大质荷比为46,所以A的相对分子质量为46;
故答案为:46;
(2)将2.3g该有机物完全燃烧,生成0.1molCO2和2.7g水,根据蒸馏水可知:n(C)=n(CO2)=0.1mol,m(C)=0.1mol×12g·mol-1=1.2g,n(H)=![]() ×2=0.3mol,m(H)=0.3mol×1g·mol-1=0.3g,该有机物分子中含有C、H元素的总质量为:1.2g+0.3g=1.5g,说明其分子中一定含有氧元素,含有氧元素质量为:m(O)=2.3g-1.2g-0.3g=0.8g,则n(O)=
×2=0.3mol,m(H)=0.3mol×1g·mol-1=0.3g,该有机物分子中含有C、H元素的总质量为:1.2g+0.3g=1.5g,说明其分子中一定含有氧元素,含有氧元素质量为:m(O)=2.3g-1.2g-0.3g=0.8g,则n(O)=![]() =0.05mol,所以n(C):n(H):n(O)=0.1mol:0.3mol:0.05mol=2:6:1,A的实验式是C2H6O,其相对分子质量是46,故其实验式即为分子式,由A的核磁共振氢谱知A中有3种氢原子,个数比为1:2:3,所以A的结构简式为:CH3CH2OH;
=0.05mol,所以n(C):n(H):n(O)=0.1mol:0.3mol:0.05mol=2:6:1,A的实验式是C2H6O,其相对分子质量是46,故其实验式即为分子式,由A的核磁共振氢谱知A中有3种氢原子,个数比为1:2:3,所以A的结构简式为:CH3CH2OH;
故答案为:CH3CH2OH。

【题目】氧化白藜芦醇W具有抗病毒等作用。下面是利用Heck反应合成W的一种方法:
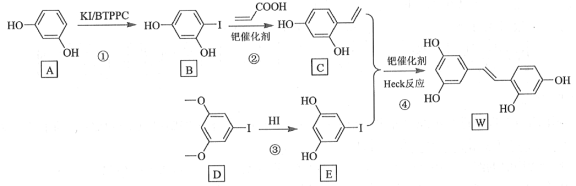
回答下列问题:
(1)A的化学名称为___________。
(2)![]() 中的官能团名称是___________。
中的官能团名称是___________。
(3)反应③的类型为___________,W的分子式为___________。
(4)不同条件对反应④产率的影响见下表:
实验 | 碱 | 溶剂 | 催化剂 | 产率/% |
1 | KOH | DMF | Pd(OAc)2 | 22.3 |
2 | K2CO3 | DMF | Pd(OAc)2 | 10.5 |
3 | Et3N | DMF | Pd(OAc)2 | 12.4 |
4 | 六氢吡啶 | DMF | Pd(OAc)2 | 31.2 |
5 | 六氢吡啶 | DMA | Pd(OAc)2 | 38.6 |
6 | 六氢吡啶 | NMP | Pd(OAc)2 | 24.5 |
上述实验探究了________和________对反应产率的影响。此外,还可以进一步探究________等对反应产率的影响。
(5)X为D的同分异构体,写出满足如下条件的X的结构简式________________。
①含有苯环;②有三种不同化学环境的氢,个数比为6∶2∶1;③1 mol的X与足量金属Na反应可生成2 g H2。
(6)利用Heck反应,由苯和溴乙烷为原料制备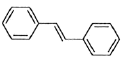 ,写出合成路线________________。(无机试剂任选)
,写出合成路线________________。(无机试剂任选)
【题目】原子序数逐渐增大的A、B、C、D、E五种短周期主族元素的部分信息如下表:
元素代号 | 信息 |
A | 原子的最外层电子数为内层电子总数的3倍 |
B | 金属性最强的短周期元素 |
C | 原子的最外层电子数是次外层的 |
D | 原子是最外层电子数A原子的最外层电子数的一半 |
E | 最高价氧化物对应的水化物是最强的无机酸 |
请根据以上信息回答问题。
(1)C的氧化物的化学式为_______________A原子结构示意图为_______________。
(2)B、C、D形成的单质的熔点从低到高的顺序为_______________(填元素符号)。
(3)A、C所形成的化合物的晶体结构与氯化钠晶体结构相似,则晶胞中每个阳离子周围等距且紧邻的阴离子数目为_______________,晶体中阴、阳离子个数比为_______________。
(4)A、D所形成晶体的熔点比C、E所形成晶体的熔点_______________(填“高”或“低”),原因是_______________