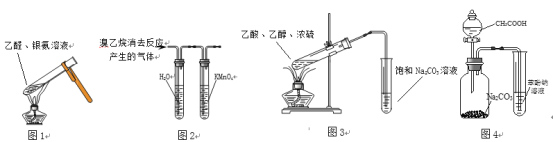
题目内容
【题目】下列事实或操作不符合平衡移动原理的是( )
A. 开启啤酒有泡沫逸出
B. H2、I2、HI平衡混合气加压后颜色变深
C. 装有NO2的烧瓶置于热水中颜色加深
D. 实验室用排饱和食盐水的方法收集氯气
【答案】B
【解析】
如果改变影响平衡的条件之一(如温度、压强、参加反应的化学物质的浓度)平衡将向着能够减弱这种改变的方向移动,称之为平衡移动原理。
A.啤酒中存在平衡CO2(g)+H2O(l)![]() H2CO3(aq)
H2CO3(aq)![]() H+(aq)+HCO3-(aq),开启啤酒瓶时瓶内气压减小,平衡向气体体积增大的方向移动,即上述平衡逆向移动,产生CO2与啤酒形成的泡沫,符合平衡移动原理,A项错误;
H+(aq)+HCO3-(aq),开启啤酒瓶时瓶内气压减小,平衡向气体体积增大的方向移动,即上述平衡逆向移动,产生CO2与啤酒形成的泡沫,符合平衡移动原理,A项错误;
B.该混合气体中存在反应:H2(g)+I2(g)![]() 2HI(g),I2(g)为紫色蒸气,加压该平衡不移动,颜色变深的原因是加压气体体积缩小,各组分的浓度增大,I2(g)浓度越大颜色越深,所以不符合平衡移动原理,B项正确;
2HI(g),I2(g)为紫色蒸气,加压该平衡不移动,颜色变深的原因是加压气体体积缩小,各组分的浓度增大,I2(g)浓度越大颜色越深,所以不符合平衡移动原理,B项正确;
C.装有NO2的烧瓶中存在反应:2NO2(g)![]() N2O4(g),NO2为红棕色气体,N2O4为无色气体,因为该反应的逆反应为吸热反应,根据烧瓶在热水中颜色加深可知,升高温度向吸热反应方向移动,符合平衡移动原理,C项错误;
N2O4(g),NO2为红棕色气体,N2O4为无色气体,因为该反应的逆反应为吸热反应,根据烧瓶在热水中颜色加深可知,升高温度向吸热反应方向移动,符合平衡移动原理,C项错误;
D.氯气溶于水时部分氯气与水反应:Cl2+H2O![]() H++Cl-+HClO,饱和食盐水中Cl-浓度很大,实验室用排饱和食盐水的方法收集氯气是因为氯气在饱和食盐水中溶解度很小,这正是增大Cl-浓度平衡向逆反应方向移动的结果,符合平衡移动原理,D项错误;答案选B。
H++Cl-+HClO,饱和食盐水中Cl-浓度很大,实验室用排饱和食盐水的方法收集氯气是因为氯气在饱和食盐水中溶解度很小,这正是增大Cl-浓度平衡向逆反应方向移动的结果,符合平衡移动原理,D项错误;答案选B。

 阅读快车系列答案
阅读快车系列答案【题目】结合所学内容,回答下列问题:
Ⅰ.某同学进行影响草酸与酸性高锰酸钾溶液反应速率因素的研究。草酸与酸性高锰酸钾的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。室温下,两支试管分别编号①和②,实验数据如下:
实验序号 | ① | ② |
加入试剂 | 4 mL 0.01mol/L酸性 KMnO4溶液 2 mL 0.1mol/L H2C2O4溶液 | 4 mL 0.01mol/L酸性 KMnO4溶液 2 mL 0.1mol/L H2C2O4溶液 一粒黄豆粒大的MnSO4固体 |
褪色时间/s | 116 | 6 |
试管①中KMnO4溶液褪色的速率开始十分缓慢,一段时间后突然加快。
请回答:
(1)该实验结论是___________________________________________________________。
(2)实验②选用MnSO4固体而不是MnCl2固体的原因是____________________________。
(3)该同学为使实验更加严密,在试管③中做了如下实验,请预测褪色时间约为_____。
实验序号 | ③ |
加入试剂 | 4 mL 0.01mol/L酸性 KMnO4溶液 2 mL 0.1mol/L H2C2O4溶液 一粒黄豆粒大的Na2SO4固体 |
褪色时间/s |
Ⅱ.滴定法是一种重要的定量分析方法,应用范围很广。某地市场上销售的一种食用精制盐包装袋上有如下部分说明:
产品等级 | 一级 |
配料 | 食盐、碘酸钾(KIO3)、抗结剂 |
碘含量(以I计) | 20~50 mg·kg-1 |
已知:IO3-+5I-+6H+ = 3I2+3H2O,I2+2S2O32- = 2I-+S4O62-某学生拟测定食用精制盐的碘含量,其步骤为
a.准确称取W g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.加入指示剂,逐滴加入物质的量浓度为2.0×10/span>-3 mol·L-1的Na2S2O3溶液10.0 mL,恰好反应完全
(4)c中加入的指示剂可选用_________,恰好完全反应时的现象是_______________。
(5)若操作b在空气中振荡时间过长,则最终测定的测定食用精制盐中的的碘含量会__________(填“偏高”、“偏低”或“没有影响”)。
(6)根据以上实验和包装说明,算得所测食用精制盐的碘含量是(以含W的代数式表示)________mg·kg-1(计算结果保留整数即可)。