题目内容
17.25℃时,将稀氨水逐滴滴加到稀硫酸中,当溶液的pH=7时,下列关系正确的是( )| A. | c(NH4+)=c(SO42-) | B. | c(NH4+)>c(SO42-) | ||
| C. | c(NH4+)<c(SO42-) | D. | c(NH4+)+c(SO42-)=c(H+)+c(NH4+) |
分析 25℃时,将稀氨水逐滴滴加到稀硫酸中,当溶液的pH=7时,则c(OH-)=c(H+),溶液中存在电荷守恒:c(OH-)+2c(SO42-)=c(H+)+c(NH4+),结合电荷守恒可知c(NH4+)>c(SO42-),据此进行解答.
解答 解:25℃时溶液的pH=7时,则c(OH-)=c(H+),
根据电荷守恒c(OH-)+2c(SO42-)=c(H+)+c(NH4+)可知:2c(SO42-)=c(NH4+),所以c(NH4+)>c(SO42-),故B正确、AC错误;
D.溶液中存在电荷守恒:c(OH-)+2c(SO42-)=c(H+)+c(NH4+),故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的分析能力及灵活应用基础知识的能力.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
8.某溶液只含有Na+、Fe3+、Cl-、SO42-4种离子,已知溶液中Na+、Fe3+、Cl-的个数之比为3:2:1.则溶液中Fe3+和SO42-的个数之比为( )
| A. | 3:4 | B. | 1:4 | C. | 1:2 | D. | 3:2 |
5.0.5molNa2SO4( )
| A. | 含3.01×1023个SO42- | B. | 标准状况下,体积约为11.2L | ||
| C. | 含0.5molNa+ | D. | 含1mol氧原子 |
12.关于反应A2(g)+3B2(g)?2C(g)△H<0在某一温度下达到平衡时,下列各种情况中,能使化学平衡常数发生改变的是( )
| A. | 升高反应温度 | B. | 其他条件不变时,通入A2气体 | ||
| C. | 加入催化剂 | D. | 保持压强不变时,充入氦气 |
2.如图:A处通入氯气.关闭B阀时,C处红色布条无变化,打开B阀时,C处红色布条褪色.由此作出的判断正确的是( )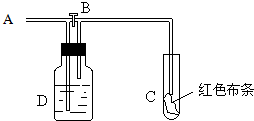

| A. | D中不可能是浓硫酸 | B. | 通入的氯气含有水蒸气 | ||
| C. | D中可以是水 | D. | D中可以是饱和食盐水 |
9.下列各组的两种物质在溶液中反应,可用同一离子方程式表示的是( )
| A. | Cu(OH)2和HCl;Cu(OH)2和CH3COOH | |
| B. | Ba(OH)2和MgSO4;BaCl2和(NH4)2SO4 | |
| C. | Na2CO3和H2SO4;K2CO3和NaHSO4 | |
| D. | NaHCO3和Ca(OH)2(过量); NaHCO3(过量)和Ca(OH)2 |

 向仅含Fe2+、I-、Br-的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如图所示. (已知氧化性:Br2>Fe3+>I2)请回答下列问题:
向仅含Fe2+、I-、Br-的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如图所示. (已知氧化性:Br2>Fe3+>I2)请回答下列问题: