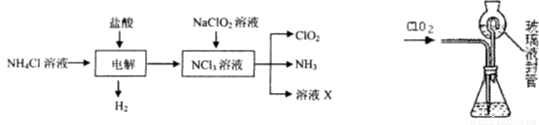
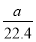ЬтФПФкШн
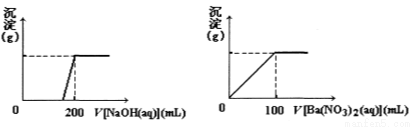
ЛЦЭПѓЕФжївЊГЩЗжXЪЧгЩCuЁЂFeЁЂSШ§жждЊЫизщГЩЕФИДбЮЃЌЦфжаCuЁЂFeСНжждЊЫиЕФжЪСПБШЮЊ8:7ЃЛНЋm g XЗлФЉШЋВПШмгк200 mLЕФХЈHNO3ЃЌЗДгІКѓЕФШмвКМгЫЎЯЁЪЭжС2ЃЎ12 LЪБВтЕУЦфpHЮЊ0ЃЛНЋЯЁЪЭКѓЕФШмвКЗжЮЊСНЕШЗнЃЌЯђЦфжавЛЗнШмвКжаЕЮМг6ЃЎ05 mol/LЕФNaOHШмвКЃЌЯђСэвЛЗнШмвКжаЕЮМг0ЃЎ600 mol/L Ba(NO3)2ШмвКЃЌСНШмвКжаОљЩњГЩГСЕэЃЌЧвГСЕэЕФжЪСПЫцЫљМгШмвКЕФЬхЛ§БфЛЏШчЯТЭМЫљЪОЃК
ЃЈ1ЃЉЧыЭЈЙ§МЦЫуШЗЖЈmЕФжЕЃЛ
ЃЈ2ЃЉXЕФФІЖћжЪСПЮЊ368 g/molЃЌЧыШЗЖЈXЕФЛЏбЇЪНЁЃ
ЃЈ1ЃЉЁОНтЮіЁП
вРЬтвтЃЌm g XжаЃКn(Cu):n(Fe)ЃН1:1
2n(Cu2ЃЋ)ЃЋ3n(Fe3ЃЋ)ЃН6ЃЎ05mol/LЁС0ЃЎ2 LЁС2?1 mol/LЁС2ЃЎ12 L
ЙЪЃКn(Cu)ЃНn(Fe)ЃН0ЃЎ06 mol ЃЈ2ЗжЃЉ
гжЃЌn(S)ЃН0ЃЎ6 mol/LЁС0ЃЎ1 LЁС2ЃН0ЃЎ12 mol
вђДЫЃЌmgЃНm(Cu)ЃЋm(Fe)ЃЋm(S)ЃН0ЃЎ06 molЁС64 g/molЃЋ0ЃЎ06 molЁС56 g/molЃЋ0ЃЎ12 molЁС32 g/molЃН 11ЃЎ04 g
МДmЕФжЕЮЊ11ЃЎ04ЃЈ2ЗжЃЉ
ЃЈ2ЃЉНтЃКЩшXЕФЛЏбЇЪНЮЊ(CuFeS2)nЃЌдђЃК(64ЃЋ56ЃЋ32ЁС2)ЁСnЃН368 nЃН2ЃЌЙЪXЕФЛЏбЇЪНЮЊCu2Fe2S4 ЃЈ2ЗжЃЉ
ЁОНтЮіЁП
ЪдЬтЗжЮіЃКЃЈ1ЃЉвРЬтвтЃЌCuЁЂFeСНжждЊЫиЕФжЪСПБШЮЊ8ЃК7ЃЌдђm g XжаЃКnЃЈCuЃЉЃКnЃЈFeЃЉ=8/64ЃК7/56=1ЃК1ЃЌЕБМгЫЎЯЁЪЭжС 2ЃЎ12 LЪБВтЕУЦфpHЮЊ0ЃЌДЫЪЧЧтРызгХЈЖШЮЊ1mol/LЃЌИљОнЭМЪОЪ§ОнЃЌЧтбѕЛЏФЦЯШжаКЭЧтРызгЃЌШЛКѓНЋН№ЪєРызгзЊЛЏЮЊГСЕэЃЌЫљвд2nЃЈCu2+ЃЉ+3nЃЈFe3+ЃЉ=6ЃЎ05mol?L-1ЁС0ЃЎ2LЁС2-1mol?L-1ЁС2ЃЎ12LЃЌ
ЙЪЃКnЃЈCuЃЉ=nЃЈFeЃЉ=0ЃЎ06molЃЌnЃЈSЃЉ=0ЃЎ600mol?L-1ЁС0ЃЎ1LЁС2=0ЃЎ12molЃЌ
вђДЫmg=mЃЈCuЃЉ+mЃЈFeЃЉ+mЃЈSЃЉ=0ЃЎ06molЁС64g?mol-1+0ЃЎ06molЁС56g?mol-1+0ЃЎ12molЁС32g?mol-1=11ЃЎ04gЃЌМДmЕФжЕЮЊ11ЃЎ04ЃЎ
ЃЈ2ЃЉЁОНтЮіЁП
ЩшXЕФЛЏбЇЪНЮЊЃЈCuFeS2ЃЉnЃЌдђЃЈ64+56+32ЁС2ЃЉЁСn=368ЃЌНтЕУЃКn=2ЃЌЙЪXЕФЛЏбЇЪНЮЊCu2Fe2S4ЃЎ
ПМЕуЃКНсКЯЭМЯѓжЊЪЖПМВщбЇЩњШЗЖЈИДдгЛЏбЇЪНЕФМЦЫуЗНЗЈЁЃ

 бєЙтЪдОэЕЅдЊВтЪдОэЯЕСаД№АИ
бєЙтЪдОэЕЅдЊВтЪдОэЯЕСаД№АИ