题目内容
下列各组性质比较中,正确的是 ( )
①酸性:HClO4>HBrO4>HIO4 ②碱性:Ba(OH)2>Mg(OH)2>Be(OH)2
③氧化性:F>C>O ④还原性:Cl<S<Si
⑤气态氢化物稳定性:HF>HCl>H2S
| A.①②③ | B.②③④ | C.①②④⑤ | D.①②③④⑤ |
C
解析试题分析:①同主族元素由上到下非金属性逐渐增强,非金属性Cl>Br>I,元素的非金属性越强,最高价氧化物的酸性越强,酸性:HClO4>HBrO4>HIO4,正确;②同主族元素由上到下金属性逐渐增强,金属性Ba>Mg>Be,元素的金属性越强,最高价氧化物的碱性越强,碱性:Ba(OH)2>Mg(OH)2>Be(OH)2,正确;③同周期元素从左到右,非金属性逐渐增强,单质的氧化性逐渐增强,应为F>O>C,错误;④同周期元素从左到右,非金属性逐渐增强,单质的氧化性逐渐增强,还原性逐渐减弱,还原性:Cl<S<Si,正确;⑤非金属性F>Cl>S,元素的非金属性越强,对应的氢化物越稳定,正确;选C。
考点:考查元素周期律。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示, 其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是( ) 
| A.非金属性:Z<T<X |
| B.R与Q的电子数相差26 |
| C.气态氢化物稳定性:R <T<Q |
| D.最高价氧化物的水化物的酸性:T>Q |
下列叙述错误的是( )
| A.13C和14C属于同一种元素,它们互为同位素 |
| B.1H和2H是不同的核素,它们的质子数相等 |
| C.14C和14N的质量数相等,它们的中子数不等 |
| D.6Li和7Li的电子数相等,中子数也相等 |
下列分子中所有原子都满足最外层8电子结构的是( )
| A.光气(COCl2) | B.六氟化硫 | C.二氟化氙 | D.三氟化硼 |
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是 ( )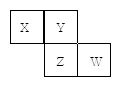
| A.原子半径:W> Z>Y>X |
| B.最高价氧化物对应水化物的酸性:Z>W>X |
| C.4种元素的单质中,Z单质的熔、沸点最低 |
| D.W单质能与水反应,生成一种具有漂白性的物质 |
下列说法正确的是;
| A.用石墨作电极,电解1mol/LNa2CO3的溶液,溶液的pH值保持不变 |
| B.非金属元素呈现的最高化合价不超过该元素的最外层电子数 |
| C.含8gNaOH的溶液中通入一定量的H2S后,将所得溶液小心蒸干,得无水物7.9g,则该无水物中一定含有Na2S |
| D.使用清洁的天然气是快速、有效地减缓大气中二氧化碳大量增加的生态学措施 |
已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示,其中X原子最外层电子数是其电子层数的2倍。下列说法正确的是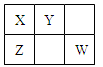
| A.四种元素的原子半径大小rY>rW>rX>rZ |
| B.元素X的含氧酸只有一种,元素Y则有两种 |
| C.元素Z的气态氢化物的稳定性比元素Y的强 |
| D.元素Y和W的氧化物是导致酸雨的主要原因 |
Se是人体必需微量元素,下列有关 Se和
Se和 Se的说法正确的是
Se的说法正确的是
A. Se 和 Se 和 Se所含电子数不同 Se所含电子数不同 | B. Se和 Se和  Se是两种不同的核素 Se是两种不同的核素 |
C. Se和 Se和  Se 分别含有44和46个质子 Se 分别含有44和46个质子 | D. Se和 Se和  Se都含有34个中子 Se都含有34个中子 |
