题目内容
下列说法或解释不正确的是
| A.等物质的量浓度的下列溶液中,①NH4Al(SO4)2 ②NH4Cl ③CH3COONH4④NH3·H2O,c(NH4+)由大到小的顺序是①>②>③>④ |
| B.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42—)>c(NH4+)>c(OH-)=c(H+) |
| C.向0.2 mol·L-1 NaHCO3溶液中加入等体积0.1 mol·L-1 NaOH溶液:c(CO32—)>c(HCO3—)>c(OH-)>c(H+) |
| D.物质的量浓度均为1 mol·L-1的NaCl和MgCl2混合液1 L中,含有Cl-的数目为3NA(NA表示阿伏加德罗常数的值)) |
C
试题分析:C项:反应后溶液中是等量的NaHCO3和Na2CO3,又因为CO32—水解比HCO3—水解大(越弱越水解),故有: C(Na+)> C(HCO3—)>C(CO32—)>C(OH—)>C(H+),故错。故选C。
点评:本题考查离子浓度的大小比较,题目难度中等,注意把握盐类水解的原理以及不同离子的水解程度,结合溶液中的守恒解答该题。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
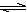 H++A2-。现有下列四种溶液:
H++A2-。现有下列四种溶液: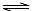 H2A+OH―
H2A+OH―