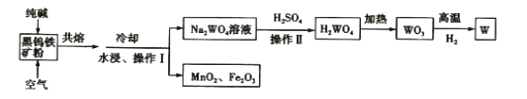
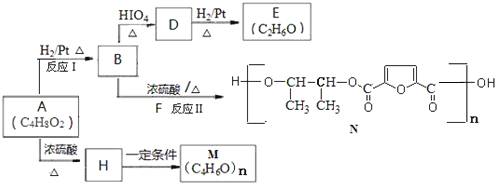
题目内容
【题目】已知:Ⅰ![]() 的燃烧热为
的燃烧热为![]()
Ⅱ![]()
![]()
![]()
Ⅲ![]()
![]()
则![]() ______。
______。
![]() 对于可逆反应
对于可逆反应![]() 采取以下措施可以提高
采取以下措施可以提高![]() 产率的是______
产率的是______![]() 填字母
填字母![]()
A.降低体系的温度![]() 压缩容器的体积
压缩容器的体积![]() 减少水量
减少水量![]() 选用适当的催化剂
选用适当的催化剂
【答案】![]() AB
AB
【解析】
①根据已知的热化学方程式和盖斯定律进行计算;
![]() 该反应为放热反应,降低体系的温度,平衡正向移动;
该反应为放热反应,降低体系的温度,平衡正向移动;
B. 该反应为气体体积缩小的可逆反应,压强增大,平衡正向移动;
C. 水为液态,增加水的量不影响平衡;
D. 催化剂不影响化学平衡。
![]() 已知:Ⅰ
已知:Ⅰ![]() 的燃烧热为
的燃烧热为![]() ,CO燃烧的热化学方程式为
,CO燃烧的热化学方程式为![]() ;
;
Ⅱ![]()
![]()
![]() ;
;
Ⅲ![]()
![]() ;
;
根据盖斯定律,Ⅰ![]() Ⅲ
Ⅲ![]() Ⅱ得:
Ⅱ得:![]()
![]()
![]() ;
;
故答案为:![]() ;
;
![]() 反应为放热反应,降低体系的温度,可以促使反应正向进行,提高了
反应为放热反应,降低体系的温度,可以促使反应正向进行,提高了![]() 转化率,故A正确;
转化率,故A正确;
B. 该反应为气体体积缩小的可逆反应,压缩容器的体积,压强增大,平衡正向移动,![]() 转化率增大,故B正确;
转化率增大,故B正确;
C. 水为液态,增加水的量不影响平衡,无法提高氢气的转化率,故C错误;
D. 催化剂不影响化学平衡,无法提高![]() 转化率,故D错误;
转化率,故D错误;
故答案为:AB。

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案【题目】为了缓解温空效应,科学家提出了多种回收和利用![]() 的方案。
的方案。
![]() 方案1:利用FeO吸收
方案1:利用FeO吸收![]() 获得
获得![]()
![]()
![]()
则![]() ______。
______。
方案2:利用![]() 制备
制备![]()
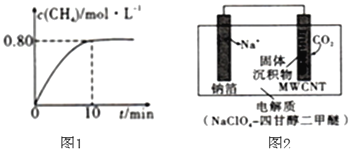
![]() 时,向2L恒容密闭容器中充入
时,向2L恒容密闭容器中充入![]() 和
和![]() 发生反应:
发生反应:![]() ,混合气体中
,混合气体中![]() 的浓度与反应时间的关系如图1所示。
的浓度与反应时间的关系如图1所示。
![]() ①从反应开始到恰好达到平衡时,
①从反应开始到恰好达到平衡时,![]() 的平均反应速率
的平均反应速率![]() ______。
______。
②![]() 时,反应的平衡常数
时,反应的平衡常数![]() ______。
______。
③保持温度不变,向平衡后的容器中再充入![]() 和
和![]() ,重新达到平衡时
,重新达到平衡时![]() 的浓度______
的浓度______![]() 填序号
填序号![]() 。
。
A.等于![]()
![]() 等于
等于![]()
![]()
![]() 大于
大于![]()
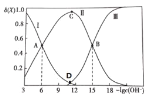
![]() 时,如果该容器中有
时,如果该容器中有![]() 、
、![]() 、
、![]() 、
、![]() 。则
。则![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() “
“![]() 。
。
![]() 已知:
已知:![]() 时,该反应的平衡常数
时,该反应的平衡常数![]() 则
则![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
方案3:利用“![]() ”电池将
”电池将![]() 变废为宝。我国科研人员研制出的可充电“
变废为宝。我国科研人员研制出的可充电“![]() ”电池以钠箔和多壁碳纳米管
”电池以钠箔和多壁碳纳米管![]() 为电极材料,总反应为
为电极材料,总反应为![]()
![]()
![]() 放电时该电池“吸入”
放电时该电池“吸入”![]() ,其工作原理如图2所示:
,其工作原理如图2所示:![]() 假设开始时两极的质量相等
假设开始时两极的质量相等![]()
![]() ①放电时,正极的电极反应式为______。
①放电时,正极的电极反应式为______。
②若生成的![]() 和C全部沉积在电极表面,当转移
和C全部沉积在电极表面,当转移![]() 时,两极的质量差为______g。
时,两极的质量差为______g。
![]() 室温下,物质的量浓度均为
室温下,物质的量浓度均为![]() 的几种含碳盐溶液的pH如下表:
的几种含碳盐溶液的pH如下表:
序号 | ① | ② | ③ |
溶液 |
| NaX |
|
pH |
|
|
|
写出溶液②中通入少量![]() 的离子方程式:______;等体积的①和③形成的混合溶液中离子浓度由大到小排列为:______
的离子方程式:______;等体积的①和③形成的混合溶液中离子浓度由大到小排列为:______
【题目】甲醇是重要的化学工业基础原料和液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度(℃) | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+ CO2(g) | K3 | ||
(1)反应②是______(填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图所示。则平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”)。
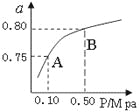
(3)判断反应③△H______0; △S______0(填“>”“=”或“<”)据反应①与②可推导出K1、K2与K3之间的关系,则K3=__________(用K1、K2表示)。在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、 CH3OH、H2O的物质的量分别为6mol、2 mol、10 mol、10 mol,此时v(正)______v(逆)(填“>”“=”或“<”)
(4)一定温度下,在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。

当曲线Ⅰ变为曲线Ⅱ时,改变的条件是___________________。
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是__________________。
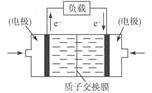
(5)甲醇燃料电池通常采用铂电极,其工作原理如图所示,负极的电极反应为:______________________。
(6)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将0.2 mol/L的醋酸与0.1 mol/LBa(OH)2溶液等体积混合,则混合溶液中离子浓度由大到小的顺序为_________________________________。