题目内容
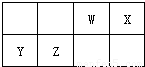
W、X、Y、Z是短周期元素,其部分性质如下表,下列说法正确的是( )
| W | 单质是淡黄色固体 | ||
| X | 在地壳中的含量居第二位 | ||
| Y | 原子最外层电子数是电子总数的
| ||
| Z | 第三周期原子半径最小的金属 |
| A、Z的氧化物属于碱性氧化物 |
| B、最高价氧化物对应水化物的酸性:Y>X |
| C、离子半径:Z>W |
| D、气态氢化物的热稳定性:X>W |
分析:W、X、Y、Z是短周期元素,W单质是淡黄色固体,则W为S;X在地壳中的含量居第二位,则X为Si;Y原子最外层电子数是电子总数的
,若Y处于第二周期,令最外层电子数为a,则(2+a)×
=a,解得a=4,为碳元素,若Y处于第三周期,令最外层电子数为a,则(2+8+a)×
=a,解得a=20,不符合题意,故Y为碳元素;Z是第三周期原子半径最小的金属,则Z为Al,结合元素周期律与元素化合物性质解答.
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
解答:解:W、X、Y、Z是短周期元素,W单质是淡黄色固体,则W为S;X在地壳中的含量居第二位,则X为Si;Y原子最外层电子数是电子总数的
,若Y处于第二周期,令最外层电子数为a,则(2+a)×
=a,解得a=4,为碳元素,若Y处于第三周期,令最外层电子数为a,则(2+8+a)×
=a,解得a=20,不符合题意,故Y为碳元素;Z是第三周期原子半径最小的金属,则Z为Al,
A.氧化铝是两性氧化物,故A错误;
B.X为Si、Y为C,非金属性C>Si,故最高价氧化物对应水化物的酸性:Y>X,故B正确;
C.S2-离子比Al3+多一个电子层,故离子半径S2->Al3+,故C错误;
D.非金属性S>Si,故氢化物稳定性H2S>SiH4,故D错误,
故选B.
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
A.氧化铝是两性氧化物,故A错误;
B.X为Si、Y为C,非金属性C>Si,故最高价氧化物对应水化物的酸性:Y>X,故B正确;
C.S2-离子比Al3+多一个电子层,故离子半径S2->Al3+,故C错误;
D.非金属性S>Si,故氢化物稳定性H2S>SiH4,故D错误,
故选B.
点评:本题考查结构性质位置关系应用,推断元素是解题关键,注意对元素周期律的理解掌握,难度中等.

练习册系列答案
相关题目
 短周期元素W、X、Y、Z在元素周期表中的位置如图所示,若Z元素的单质是可用于制造太阳能电池的半导体材料.下列说法中,正确的是( )
短周期元素W、X、Y、Z在元素周期表中的位置如图所示,若Z元素的单质是可用于制造太阳能电池的半导体材料.下列说法中,正确的是( )