题目内容
晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如下:①高温下用碳还原二氧化硅制得粗硅。
②粗硅与干燥的HCl气体反应制得SiHCl3:Si+3HCl
 SiHCl3+H2。
SiHCl3+H2。③SiHCl3与过量的H2在1000~1100℃时反应制得纯硅。
已知SiHCl3(沸点33.0℃)能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学方程式为____________________。
(2)用SiHCl3与过量的H2反应制备纯硅的装置如下(热源及夹持装置已略去):
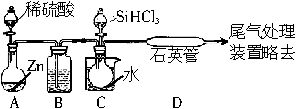
①装置B中的试剂是______________,装置C中的烧瓶需要加热,其目的是_______________。
②反应一段时间后,装置D中观察到的现象是__________________,装置D不能采用普通玻璃管的原因是______________,装置D中发生反应的化学方程式为_______________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及_________________________。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是_____________。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
(1)SiO2+2C
 Si+2CO↑
Si+2CO↑ (2)①浓硫酸; 使滴入烧瓶中的SiHCl3汽化; ②有固体物质生成; 在反应温度下,普通玻璃会软化;SiHCl3+H2
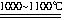 Si+3HCl ; ③排尽装置中的空气; ④bd
Si+3HCl ; ③排尽装置中的空气; ④bd【试题分析】
解析:由(2)中的实验装置图可以看出:A为制取氢气的装置,B为干燥氢气的装置。由SiHCl3的沸点可知其在常温下为液态,对C装置加热可以使其汽化,从而保证SiHCl3和氢气充分接触并进入D中,在较高温度下发生反应得到单质硅。SiHCl3与H2反应所需的较高温度会使普通玻璃软化,写化学方程式时也要特别注明温度。将试样用稀盐酸溶解后,再在溶液中依次加入氯水(氯水能将Fe2+氧化为Fe3+)和KSCN溶液,若溶液变为血红色,则说明样品中含有铁单质,不变血红色则说明样品中不含铁单质。

练习册系列答案
相关题目
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层.
①请写出基态镍原子的核外电子排布式______.
②NiO、FeO的晶体结构类型均与氯化钠相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO______(填“<”或“>”)FeO;
③Ni、Fe、Co等金属都能与CO反应形成配合物,Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于______(填晶体类型);配位体是______.
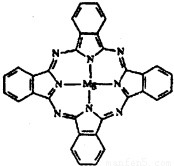
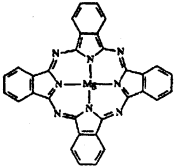
(2)金属酞菁配合物在硅太阳能电池中有重要作用,一种金属镁酞菁配合物的结构如下图,请在下图中用箭头表示出配位键.
(3)CO与N2互为等电子体.CO的总键能大于N2的总键能,但CO比N2容易参加化学反应.根据下表数据,说明CO比N2活泼的原因是______.
(4)CO与N2分子中都包含______个σ键、______个π键.
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层.
①请写出基态镍原子的核外电子排布式______.
②NiO、FeO的晶体结构类型均与氯化钠相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO______(填“<”或“>”)FeO;
③Ni、Fe、Co等金属都能与CO反应形成配合物,Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于______(填晶体类型);配位体是______.
(2)金属酞菁配合物在硅太阳能电池中有重要作用,一种金属镁酞菁配合物的结构如下图,请在下图中用箭头表示出配位键.
(3)CO与N2互为等电子体.CO的总键能大于N2的总键能,但CO比N2容易参加化学反应.根据下表数据,说明CO比N2活泼的原因是______.
| A-B | A=B | A≡B | ||
| CO | 键能 | 357.7 | 798.9 | 1071.9 |
| 键能差值 | 441.2 273 | |||
| N2 | 键能 | 154.8 | 418.3 | 941.7 |
| 键能差值 | 263.6 523.3 | |||

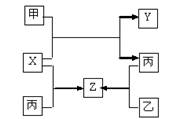
甲、乙、丙是三种常见单质,X、Y、Z是常见化合物,他们之间有如下转化关系: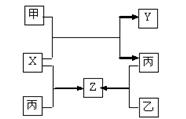
已知甲是短周期金属单质,乙、丙是短周期非金属单质,X、Y、Z中只有一种是离子晶体。下列说法不正确的是
| A.X是具有极性键的非极性分子 | B.Z是水煤气的主要成分之一 |
| C.甲和X的反应是吸热反应 | D.丙是生产硅的重要原料 |
 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.