题目内容
【题目】下列关于元素电负性大小的比较中,不正确的是( )
A.O<S<Se<Te
B.C<N<O<F
C.P<S<O<F
D.K<Na<Mg<Al
【答案】A
【解析】解:A、元素的非金属性越强,电负性越强,元素的非金属性:Te<Se<S<O,则电负性为Te<Se<S<O,故A错误; B、同周期自左而右电负性增大,故电负性C<N<O<F,故B正确;
C、同一周期元素从左到右电负性逐渐增大,因此F>O、S>P,同一主族元素从上到下电负性逐渐减小,所以电负性O>S,故电负性:F>O>S>P,故C正确;
D、一般来说,元素非金属性越强电负性越小,金属性越强,电负性越小,即K<Na<Mg<Al,故D正确;
故选A.

 名校课堂系列答案
名校课堂系列答案【题目】某学生欲通过实验方法验证Fe2+的性质.
(1)该同学在实验前,依据Fe2+的性,填写了下表.
实验操作 | 预期现象 | 反应的离子方程式 |
向盛有新制FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液颜色逐渐变黄 | Fe2++NO |
依照表中操作,该同学进行实验.观察到液面上方气体逐渐变为红棕色,但试管中溶液颜色却变为深棕色.
(2)为了进一步探究溶液变成深棕色的原因,该同学进行如下实验.向原新制FeSO4溶液和反应后溶液中均加入KSCN溶液,前者不变红色,后者(加了数滴浓硝酸的FeSO4溶液)变红.该现象的结论是 .
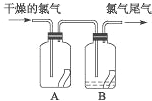
(3)该同学通过查阅资料,认为溶液的深棕色可能是NO2或NO与溶液中Fe2+或Fe3+发生反应而得到的.为此他利用如图装置(气密性已检验,尾气处理装置略)进行探究.ⅰ.打开活塞a、关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化.
ⅱ.打开活塞b、关闭a,一段时间后再停止甲中反应.
ⅲ.为与ⅰ中实验进行对照,更换丙、丁后(溶质不变),使甲中反应继续,观察到的现象与步骤ⅰ中相同.
①铜与足量浓硝酸反应的化学方程式是;
②装置乙的作用是;
③步骤ⅱ的目的是;
④该实验可得出的结论是 .
(4)该同学重新进行(1)中实验,观察到了预期现象,其实验操作是 .
【题目】将甲、乙两种有机混合物在常温常压下分离,已知它们的物理性质如下:
物质 | 密度(g/ml﹣3) | 沸点(℃) | 水溶性 | 溶解性 |
甲 | 0.7893 | 78.5 | 溶 | 溶于乙 |
乙 | 1.220 | 100.7 | 溶 | 溶于甲 |
则采用的分离方法是( )
A.分液
B.蒸馏
C.干馏
D.萃取
【题目】下列根据实验操作和现象所得出的结论正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 将气体X通入品红溶液中 | 红色褪去 | X一定是SO2 |
B | 向无色溶液中加硝酸酸化的BaCl2溶液 | 有白色沉淀 | 原溶液中一定含SO |
C | 向Na2SiO3溶液中通入适量CO2气体 | 出现白色沉淀 | H2CO3的酸性比H2SiO3强 |
D | 向某溶液中先加氯水再加KSCN溶液 | 溶液呈血红色 | 原溶液中一定含Fe2+ |
A. A B. B C. C D. D