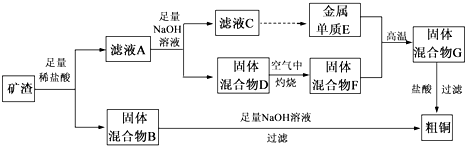
题目内容
【题目】(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是 .
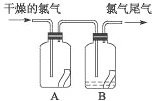
(2)为防止氯气尾气污染空气,根据氯水显酸性的性质,可用 溶液吸收多余的氯气,原理是(用化学方程式表示) .根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是 (填化学式),长期露置于空气中的漂白粉,加稀盐酸后产生的气体是 (用字母代号填).
A.O2 B.Cl2 C.CO2 D.HClO.
【答案】(1)潮湿的有色布条褪色而干燥的有色布条不褪色;
(2)NaOH;2NaOH+Cl2═NaClO+NaCl+H2O;Ca(ClO)2; C.
【解析】(1)氯气没有漂白性,所以干燥的氯气不能使有色布条褪色,氯气和水反应生成盐酸和次氯酸,次氯酸有强氧化性而使有色布条褪色,所以看到的现象是A中有色布条不褪色,B中有色布条褪色,
(2)氯水显酸性,可以用碱性物质氢氧化钠溶液吸收,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应方程式为:2NaOH+Cl2═NaClO+NaCl+H2O;氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,漂白粉的有效成分是Ca(ClO)2,次氯酸钙和二氧化碳反应生成碳酸钙,碳酸钙和盐酸反应生成二氧化碳,所以长期露置于空气中的漂白粉,加稀盐酸后产生的气体是二氧化碳,故选C,

 优加精卷系列答案
优加精卷系列答案【题目】另一化学研究性学习小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定.已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应).
(1)步骤一:电解精制:电解时,粗铜应与电源的极相连.阴极上的电极反应式为 .
(2)步骤二:电解完成后,该小组同学按以下流程对电解液进行处理: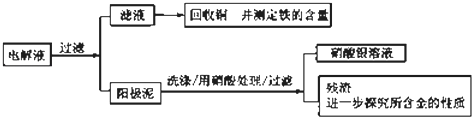
①阳极泥的综合利用:稀硝酸处理阳极泥得到硝酸银稀溶液,请写出该步反应的离子方程式: , 残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的信息:
序号 | 反应 | 平衡常数 |
1 | Au+6HNO3Au(NO3)3+3NO2↑+3H2O | <<1 |
2 | Au3++4Cl﹣AuCl4- | >>1 |
请根据以上信息简要解释溶解阳极泥不用王水的原因 .
②滤液含量的测定:以下是该小组探究滤液的一个实验流程.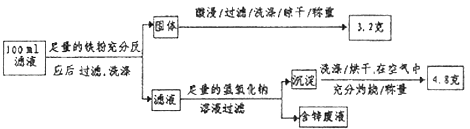
则100mL滤液中Cu2+的浓度为 molL﹣1 , Fe2+的浓度为 molL﹣1 .