题目内容
含有a mol FeI2的溶液中,通入x mol Cl2.下列各项为通入Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是
- A.x≤a,

- B.x=1.2a,
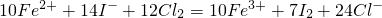
- C.x=1.4a,
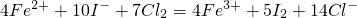
- D.x≥1.5a,
B
分析:a mol FeI2的溶液中含amolFe2+,2amolI-,还原性顺序为I->Fe2+,通入xmolCl2发生的反应依次为:①2I-+Cl2=2Cl-+I2;②2Fe2++Cl2=2Fe3++2Cl-;依据离子方程式和所给物质中离子的物质的量计算判断.
解答:a mol FeI2的溶液中含amolFe2+,2amolI-,还原性顺序为I->Fe2+,通入xmolCl2发生的反应依次为:
①2I-+Cl2=2Cl-+I2;②2Fe2++Cl2=2Fe3++2Cl-;③2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-;
若氯气少量发生①2I-+Cl2=2Cl-+I2 可知x=a;
若氯气过量发生③2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-;计算得到x=1.5a;
若a<x<1.5a时,反应按照①全部反应,②亚铁离子部分氧化;
A、x≤a时 氯气少量只氧化碘离子,反应离子方程式为:2I-+Cl2=2Cl-+I2 ,故A正确;
B、x=1.2a介于a<x<1.5a间,依据x:a=12:10=6:5,氯气为6mol,I-为10mol,Fe2+为5mol,利用①②直平法写出离子方程式为:2Fe2++10I-+6Cl2=2Fe3++5I2+12Cl-,故B错误;
C、x=1.4a介于a<x<1.5a间,依据x:a=14:10=7:5,氯气为7mol,I-为10mol,Fe2+为5mol,利用①②直平法写出离子方程式为:4Fe2++10I-+7Cl2=4Fe3++5I2+14Cl-,故C正确;
D、x≥1.5a,氯气足量把碘离子和亚铁离子全部氧化,反应的离子方程式为:2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-,故D正确;
故选B.
点评:本题考查了氧化还原反应的电离分析判断,主要是离子还原性顺序的掌握,和不同范围内产物的判断,氧化还原反应实质的应用.题目难度较大.
分析:a mol FeI2的溶液中含amolFe2+,2amolI-,还原性顺序为I->Fe2+,通入xmolCl2发生的反应依次为:①2I-+Cl2=2Cl-+I2;②2Fe2++Cl2=2Fe3++2Cl-;依据离子方程式和所给物质中离子的物质的量计算判断.
解答:a mol FeI2的溶液中含amolFe2+,2amolI-,还原性顺序为I->Fe2+,通入xmolCl2发生的反应依次为:
①2I-+Cl2=2Cl-+I2;②2Fe2++Cl2=2Fe3++2Cl-;③2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-;
若氯气少量发生①2I-+Cl2=2Cl-+I2 可知x=a;
若氯气过量发生③2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-;计算得到x=1.5a;
若a<x<1.5a时,反应按照①全部反应,②亚铁离子部分氧化;
A、x≤a时 氯气少量只氧化碘离子,反应离子方程式为:2I-+Cl2=2Cl-+I2 ,故A正确;
B、x=1.2a介于a<x<1.5a间,依据x:a=12:10=6:5,氯气为6mol,I-为10mol,Fe2+为5mol,利用①②直平法写出离子方程式为:2Fe2++10I-+6Cl2=2Fe3++5I2+12Cl-,故B错误;
C、x=1.4a介于a<x<1.5a间,依据x:a=14:10=7:5,氯气为7mol,I-为10mol,Fe2+为5mol,利用①②直平法写出离子方程式为:4Fe2++10I-+7Cl2=4Fe3++5I2+14Cl-,故C正确;
D、x≥1.5a,氯气足量把碘离子和亚铁离子全部氧化,反应的离子方程式为:2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-,故D正确;
故选B.
点评:本题考查了氧化还原反应的电离分析判断,主要是离子还原性顺序的掌握,和不同范围内产物的判断,氧化还原反应实质的应用.题目难度较大.

练习册系列答案
相关题目
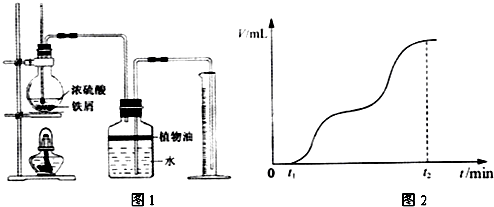
 甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.
甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答. Fe2(SO4)3 + 3SO2↑+ 6H2O。请你参与探究并回答相关问题。
Fe2(SO4)3 + 3SO2↑+ 6H2O。请你参与探究并回答相关问题。