题目内容
15.下列说法正确的是( )| A. | 将AgBr放入水中不能导电,故AgBr不是电解质 | |
| B. | CO2溶于水得到的溶液能导电,所以CO2是电解质 | |
| C. | 熔融的金属能导电,所以金属是电解质 | |
| D. | 固态的NaCl不导电,但 NaCl是电解质 |
分析 水溶液中或熔融状态下导电的化合物为电解质,包括酸、碱、盐和活泼金属氧化物、水,据此判断.
解答 解:A.溴化银在熔融状态下能够导电,属于电解质,故A错误;
B.二氧化碳溶于水生成电解质碳酸,碳酸电离产生自由离子而导电,但是二氧化碳本身不能电离,属于非电解质,故B错误;
C.金属属于单质,不是化合物,不是电解质,故C错误;
D.氯化钠在熔融状态下或者溶于水都能导电,属于电解质,故D正确;
故选:D.
点评 本题考查了对电解质概念的理解,明确电解质的概念是解题关键,注意电解质必须是化合物,必须本身能电离,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.已知4NH3(g)+5O2(g)?4NO(g)+6H2O(g),若反应速率分别用υ(NH3)、υ(O2)、υ(NO)、υ(H2O)表示,则正确的关系式为( )
| A. | 2υ(NO)=3υ(H2O) | B. | 5υ(O2)=6υ(H2O) | C. | υ(NH3)=υ(H20) | D. | 5υ(NH3)=4υ(O2) |
3.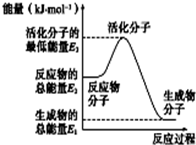 已知:①N2(g)+O2(g)=2NO(g)△H1=+180kJ•mol-1
已知:①N2(g)+O2(g)=2NO(g)△H1=+180kJ•mol-1
②N2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ•mol-1
③2H2(g)+O2(g)=2H2O(g)△H3=-483.6kJ•mol-1
下列说法正确的是( )
 已知:①N2(g)+O2(g)=2NO(g)△H1=+180kJ•mol-1
已知:①N2(g)+O2(g)=2NO(g)△H1=+180kJ•mol-1②N2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ•mol-1
③2H2(g)+O2(g)=2H2O(g)△H3=-483.6kJ•mol-1
下列说法正确的是( )
| A. | 反应②中的能量变化如右图所示,则△H2=E1-E3 | |
| B. | H2的燃烧热为241.8 kJ•mol-1 | |
| C. | 由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 | |
| D. | 氨的催化氧化反应为4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=+906 kJ•mol-1 |
20.下列离子方程式书写正确的是( )
| A. | 钠与水反应:Na+2H2O═Na++OH-+H2↑ | |
| B. | 铁与硫酸铜溶液反应:Fe+Cu2+═Fe2++Cu | |
| C. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ |
4.某核素的质量数为A,其阴离子Xn-核外有x个电子.有关该微粒的描述正确的是( )
| A. | Xn-的原子核内一定有(A-x-n)个中子 | |
| B. | Xn-的原子核内一定有(x-n)个质子 | |
| C. | Xn-的最外层一定具有8电子稳定结构 | |
| D. | Xn-的次外层一定排布了8个电子 |
