题目内容
【题目】一定条件下铁可以和CO2发生反应:
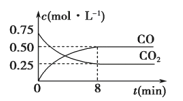
Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,1 100 ℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示。
FeO(s)+CO(g) ΔH>0,1 100 ℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示。
(1)该反应的平衡常数表达式K=____________。
(2)下列措施中能使平衡常数K增大的是__________(填序号)
A.升高温度 B.增大压强 C.充入一定量CO D.降低温度
(3)8 min内,CO的平均反应速率v(CO)=____________mol·L-1·min-1。
(4)1 100 ℃时,2 L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 |
反应物投入量 | 3 mol Fe、2 mol CO2 | 4 mol FeO、3 mol CO |
CO的浓度(mol·L-1) | c1 | c2 |
CO2的体积分数 | φ1 | φ2 |
体系压强(Pa) | p1 | p2 |
气态反应物的转化率 | α1 | α2 |
①下列说法正确的是____________。
A.2c1=3c2 B.φ1=φ2 C.p1<p2 D.α1=α2
②求c1=____________、φ1=____________、α2=____________。
【答案】(1)![]() (2)A(3)0.0625
(2)A(3)0.0625
(4)①BC ②0.67 mol·L-1;33.3% ;33.3%
【解析】
试题分析:(1)Fe(s)+CO2(g)![]() FeO(s)+CO(g),依据平衡常数概念书写,注意固体和纯液体不写入表达式,表达式为:K=
FeO(s)+CO(g),依据平衡常数概念书写,注意固体和纯液体不写入表达式,表达式为:K= ![]() 。
。
(2)平衡常数随温度变化,不随浓度压强等因素变化,反应是吸热反应,升温平衡时K增大;A.升高温度,平衡正向进行,平衡常数增大,故A正确;B.增大压强,平衡不动,平衡常数不变,故B错误;C.充入一定量CO,平衡逆向进行,但平衡常数不变,故C错误;D.降低温度,平衡逆向进行,平衡常数减小,故D错误。故答案为:A;
(3)依据图象分析,8分钟内,一氧化碳浓度变化0.5mol/L,CO的平均反应速率v(CO)=△c/△t=0.5mol/L÷8min=0.0625mol/Lmin。故答案为:0.0625;
(4)①依据图表数据分析,反应前后气体体积不变,加入2molCO2,加入3mol CO,相当于加入3molCO2,平衡时气体体积分数相同,物质的量不同,压强不同,气体物质的量大的容器中压强大,起始量不同,平衡浓度、转化率不同。A.达到平衡状态,一氧化碳的浓度关系为:3c1=2c2,故A错误;B.反应物和生成物都是一种,平衡常数相同,所以达到平衡状态二氧化碳的体积分数相同,φ1=φ2,故B正确;C.乙容器中气体物质的量大于甲容器,所以达到平衡状态p1<p2,故C正确;D.起始量不同,甲容器正向进行,乙容器逆向进行,反应前后气体体积不变,气态反应物的转化率不相同,故D错误。故答案为:BC;
②图象分析反应在1100°C反应的平衡常数K=0.50/0.25=2
甲容器中设反应的二氧化碳浓度为x
Fe(s)+CO2(g)![]() FeO(s)+CO(g),
FeO(s)+CO(g),
起始量(mol/L)1 0
变化量(mol/L)x x
平衡量(mol/L)1-x x
K=x/(1-x)=2,解得x=2/3mol/L
平衡状态一氧化碳的浓度=2/3mol/L=0.67mol/L,
CO2的体积分数φ1=(1-x)/1×100%=1/3×100%=33.3%;
乙容器中温度和甲容器相同,平衡常数相同,所以二氧化碳的体积分数φ2=φ1 =33.3%。
故答案为:0.67molL-1 33.3% 33.3%。

 口算题天天练系列答案
口算题天天练系列答案