题目内容
【题目】氯及其化合物在生活和生产中应用广泛。
(1)已知:900 K时,4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g),反应自发。
2Cl2(g)+2H2O(g),反应自发。
①该反应是放热还是吸热,判断并说明理由___________________________。
②900 K时,体积比为4∶1的HCl和O2在恒温恒容的密闭容器中发生反应,HCl的平衡转化率α(HCl)随压强(p)变化曲线如图。保持其他条件不变,升温到T K(假定反应历程不变),请画出压强在1.5×105~4.5×105Pa范围内,HCl的平衡转化率α(HCl)随压强(p)变化曲线示意图。_____________________

(2)已知:Cl2(g)+2NaOH(aq)===NaCl(aq)+NaClO(aq)+H2O(l) ΔHl=-102 kJ·mol-1
3Cl2(g)+6NaOH(aq)===5NaCl(aq)+NaClO3(aq)+3H2O(l) ΔH2=-422 kJ·mol-1
①写出在溶液中NaClO分解生成NaClO3的热化学方程式:________________________________。
②用过量的冷NaOH溶液吸收氯气,制得NaClO溶液(不含NaClO3),此时ClO-的浓度为c0 mol·L-1;加热时NaClO转化为NaClO3,测得t时刻溶液中ClO-浓度为ct mol·L-1,写出该时刻溶液中Cl-浓度的表达式:c(Cl-)=________________(用c0、ct表示)mol·L-1。
③有研究表明,生成NaClO3的反应分两步进行:
Ⅰ.2ClO-===ClO![]() + Cl-
+ Cl-
Ⅱ.ClO![]() +ClO-===ClO
+ClO-===ClO![]() +Cl-
+Cl-
常温下,反应Ⅱ能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,试用碰撞理论解释其原因:______________________________________________________。
【答案】 放热反应,ΔS<0且反应自发 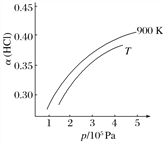 3NaClO(aq)===2NaCl(aq)+NaClO3(aq) ΔH=-116 kJ·mol-1 c0+
3NaClO(aq)===2NaCl(aq)+NaClO3(aq) ΔH=-116 kJ·mol-1 c0+![]() (或
(或![]() ) 反应Ⅰ的活化能高,活化分子百分数低,不利于ClO-向ClO
) 反应Ⅰ的活化能高,活化分子百分数低,不利于ClO-向ClO![]() 转化
转化
【解析】(1)①900Κ时,4HCl(g)+O22Cl2(g)+2H2O(g),△S<0,反应自发满足△H-T△S<0,△H<0,故答案为:放热,△S<0,反应自发满足△H-T△S<0;
②900K时,体积比为4:1的HCl和O2在恒温恒容的密闭容器中发生反应,HCl的平衡转化率α(HCl)随压强(P)变化曲线如图。保持其他条件不变,升温到TK,平衡逆向进行,HCl转化率减小,随压强增大平衡正向进行,HCl转化率增大,据此画出图象为: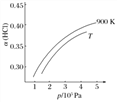 ,故答案为:
,故答案为: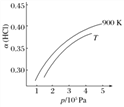 ;
;
(2)①Ⅰ.Cl2(g)+2NaOH(aq)=NaCl(aq)+NaClO(aq)+H2O(l)△Hl=-102kJmol-1,Ⅱ.3Cl2(g)+6NaOH(aq)=5NaCl(aq)+NaClO3(aq)+3H2O(1)△H2=-422kJmol-1,盖斯定律计算Ⅱ-Ⅰ×3得到NaClO分解生成NaClO3的热化学方程式:
3NaClO(aq)=2NaCl(aq)+NaClO3(aq)△H=-116KJ/mol,故答案为:3NaClO(aq)=2NaCl(aq)+NaClO3(aq)△H=-116KJ/mol;
②用过量的冷NaOH溶液吸收氯气,制得NaClO溶液(不含NaClO3),此时ClO-的浓度为c0molL-1,则Cl2(g)+2NaOH(aq)=NaCl(aq)+NaClO(aq)+H2O(l)反应中生成氯离子浓度为c0molL-1,加热时NaClO转化为NaClO3,测得t时刻溶液中ClO-浓度为c1molL-1,反应的次氯酸钠浓度=c0molL-1-c1molL-1
3NaClO(aq)=2NaCl(aq)+NaClO3(aq)
3 2
c0molL-1-c1molL-1 ![]() ×(c0molL-1-c1molL-1)
×(c0molL-1-c1molL-1)
该时刻溶液中Cl-浓度的表达式:c0molL-1+![]() ×(c0molL-1-c1molL-1 )=
×(c0molL-1-c1molL-1 )= ![]() ,故答案为:
,故答案为: ![]() ;
;
③③常温下,反应II能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,说明反应进行决定于反应Ⅰ,反应Ⅰ的活化能高,活化分子百分数低,不利于ClO-向ClO3-转化,故答案为:反应Ⅰ的活化能高,活化分子百分数低,不利于ClO-向ClO3-转化。

【题目】有4支试管中分别进行如下表所示实验,结论正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH |
B | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+、无K+ |
C | 滴加氯水和CCl4,振荡,静置 | 下层溶液显紫色 | 原溶液中有I- |
D | 通入过量CO2气体 | 生成白色沉淀 | 原溶液中只有AlO |
A. A B. B C. C D. D




