题目内容
饱和氯水与石灰石反应是制取较浓HClO溶液的方法之一。某兴趣小组进行了如下实验探究。
实验一:定性研究。
①在试管中加入过量的块状碳酸钙,再加入约20 mL饱和氯水(如图所示),充分反应,有少量气泡产生,溶液浅黄绿色退去;
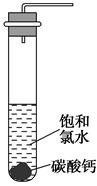
②过滤,将滤液滴在有色布条上,发现滤液比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
第三份滤液加热,看到滤液变浑浊且有大量无色气体产生。经检测,上述实验中产生的无色气体均为CO2。
请回答:
(1)反应后所得的溶液漂白性比氯水强的原因是 。
(2)依据上述实验可推知:滤液中的溶质除CaCl2、HClO外,还有 (填写溶质的化学式)。
实验二:定量研究。
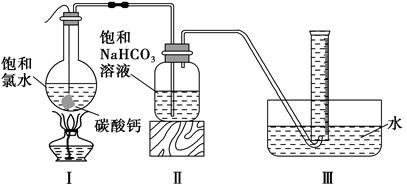
在圆底烧瓶底部,用一塑料网包住块状石灰石(过量)与150 mL饱和氯水反应,按下图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,将装置密封后再加热,煮沸烧瓶中的液体,量筒中的气体不再增加时停止实验。
请回答:
(3)实验结束后检测到量筒中收集到的气体除CO2外还有O2,请写出Ⅰ中产生O2的化学反应方程式 。
(4)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,请你对装置Ⅲ进行改进(水槽中仍为水),最简单的方法是 。
实验一:定性研究。
①在试管中加入过量的块状碳酸钙,再加入约20 mL饱和氯水(如图所示),充分反应,有少量气泡产生,溶液浅黄绿色退去;

②过滤,将滤液滴在有色布条上,发现滤液比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
第三份滤液加热,看到滤液变浑浊且有大量无色气体产生。经检测,上述实验中产生的无色气体均为CO2。
请回答:
(1)反应后所得的溶液漂白性比氯水强的原因是 。
(2)依据上述实验可推知:滤液中的溶质除CaCl2、HClO外,还有 (填写溶质的化学式)。
实验二:定量研究。
在圆底烧瓶底部,用一塑料网包住块状石灰石(过量)与150 mL饱和氯水反应,按下图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,将装置密封后再加热,煮沸烧瓶中的液体,量筒中的气体不再增加时停止实验。

请回答:
(3)实验结束后检测到量筒中收集到的气体除CO2外还有O2,请写出Ⅰ中产生O2的化学反应方程式 。
(4)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,请你对装置Ⅲ进行改进(水槽中仍为水),最简单的方法是 。
(1)CaCO3消耗了氯水中的盐酸,使可逆反应Cl2+H2O HCl+HClO的平衡向右移动,HClO浓度增大
HCl+HClO的平衡向右移动,HClO浓度增大
(2)Ca(HCO3)2
(3)2HClO 2HCl+O2↑
2HCl+O2↑
(4)将水槽中的水换为热水(答案合理即可)
 HCl+HClO的平衡向右移动,HClO浓度增大
HCl+HClO的平衡向右移动,HClO浓度增大(2)Ca(HCO3)2
(3)2HClO
 2HCl+O2↑
2HCl+O2↑(4)将水槽中的水换为热水(答案合理即可)
(1)由于次氯酸的酸性弱于碳酸的酸性,但强于HCO3-的酸性,所以碳酸钙只与盐酸反应,与氯水中的次氯酸是不反应的。即CaCO3消耗了氯水中的盐酸,使可逆反应Cl2+H2O HCl+HClO的平衡向右移动,HClO浓度增大,所以漂白性增强。
HCl+HClO的平衡向右移动,HClO浓度增大,所以漂白性增强。
(2)第一份滤液与石灰水混合,立即产生大量白色沉淀,第二份与稀盐酸混合,立即产生大量CO2,因此可以判断白色沉淀是碳酸钙,所以滤液中还存在的溶质是碳酸氢钙。
(3)次氯酸不稳定,受热易分解生成氧气和氯化氢,反应方程式为2HClO 2HCl+O2↑。
2HCl+O2↑。
(4)气体的溶解度随温度的升高而降低,所以要减小CO2溶解带来的损耗,可以将水槽中的水换为热水。
 HCl+HClO的平衡向右移动,HClO浓度增大,所以漂白性增强。
HCl+HClO的平衡向右移动,HClO浓度增大,所以漂白性增强。(2)第一份滤液与石灰水混合,立即产生大量白色沉淀,第二份与稀盐酸混合,立即产生大量CO2,因此可以判断白色沉淀是碳酸钙,所以滤液中还存在的溶质是碳酸氢钙。
(3)次氯酸不稳定,受热易分解生成氧气和氯化氢,反应方程式为2HClO
 2HCl+O2↑。
2HCl+O2↑。(4)气体的溶解度随温度的升高而降低,所以要减小CO2溶解带来的损耗,可以将水槽中的水换为热水。

练习册系列答案
相关题目


 NH4NO2+NaCl
NH4NO2+NaCl

