题目内容
下列反应中,盐酸既表现出还原性又表现出酸性的是
[ ]
A.CaCO3+2HCl=CaCl2+H2O+CO2↑
B.Fe +2HCl=FeCl2+H2↑
C.MnO2+4HCl(浓) MnCl2 +Cl2↑+2H2O
MnCl2 +Cl2↑+2H2O
D.NaOH+HCl=NaCl+H2O
B.Fe +2HCl=FeCl2+H2↑
C.MnO2+4HCl(浓)
 MnCl2 +Cl2↑+2H2O
MnCl2 +Cl2↑+2H2O D.NaOH+HCl=NaCl+H2O
C

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
判断含氧酸酸性强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性就越强.含氧酸酸性强弱与非羟基氧原子数的关系如下表所示:
(1)亚磷酸H3PO3和亚砷酸H3AsO3分子式相似,但它们的酸性差别很大,H3PO3是中强酸,H3AsO3既有弱酸性又有弱碱性.由此可推断它们的结构式分别为:① ;② .
(2)H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是:① ;② .
(3)在H3PO3和H3AsO3中分别加入浓盐酸,化学方程式为: ; .
请按要求回答下列问题:
(4)指出下面物质分子或离子的空间构型:PO43- ;CS2 .
(5)有两种活性反应中间体微粒,它们的微粒中均含有1个碳原子和3个氢原子.根据下面给出的这两种微粒的球棍模型,写出相应的化学式:
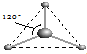 ;
;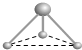 .
.
(6)按要求写出第二周期非金属元素构成的中性分子的化学式:平面形分子 ;三角锥形分子 ;四面体形分子 .
| 名称 | 次氯酸 | 磷酸 | 硫酸 | 高氯酸 |
| 结构式 | Cl-OH | 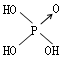 |
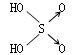 |
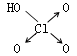 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
(2)H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是:①
(3)在H3PO3和H3AsO3中分别加入浓盐酸,化学方程式为:
请按要求回答下列问题:
(4)指出下面物质分子或离子的空间构型:PO43-
(5)有两种活性反应中间体微粒,它们的微粒中均含有1个碳原子和3个氢原子.根据下面给出的这两种微粒的球棍模型,写出相应的化学式:


(6)按要求写出第二周期非金属元素构成的中性分子的化学式:平面形分子
几种短周期元素的原子半径和主要化合价见下表:
元素代号 | X | Y | Z | L | M | Q |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.077 | 0.074 |
主要化合价 | +2 | +3 | +6、-2 | +7、-1 | +4、-4 | -2 |
下列说法中,正确的是
A.在化学反应中,M原子既不容易失去电子,又不容易得到电子
B.等物质的量的X、Y的单质与足量盐酸反应,生成H2一样多
C.Y与Q形成的化合物不可能跟氢氧化钠溶液反应
D.Z的氢化物的稳定性强于L的氢化物的稳定性
几种短周期元素的原子半径和主要化合价见下表:
元素代号 | X | Y | Z | L | M | Q |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.077 | 0.074 |
主要化合价 | +2 | +3 | +6、-2 | +7、-1 | +4、-4 | -2 |
下列说法中,正确的是
A.在化学反应中,M原子既不容易失去电子,又不容易得到电子
B.等物质的量的X、Y的单质与足量盐酸反应,生成H2一样多
C.Y与Q形成的化合物不可能跟氢氧化钠溶液反应
D.Z的氢化物的稳定性强于L的氢化物的稳定性

