题目内容
3.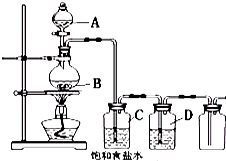 用下列装置制取并收集纯净的氯气,试回答下列问题:
用下列装置制取并收集纯净的氯气,试回答下列问题:(1)装置B中发生反应的化学方程式为4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)装置C的作用是除去氯气中的氯化氢.
(3)装置D中的试剂为浓硫酸.
(4)请指出该装置的不足之处缺少尾气处理装置; 如何改进应用NaOH溶液吸收多余的氯气..
分析 (1)二氧化锰与浓盐酸在加热条件下发生反应生成氯化锰、氯气和水;
(2)浓盐酸易挥发,从A中得到的氯气中含有氯化氢,氯化氢易溶于水,氯气在饱和食盐水溶解度不大;
(3)浓硫酸具有吸水性,可以干燥氯气,除去氯气中的水蒸气;
(4)氯气有毒,不能直接排放,应用氢氧化钠溶液吸收.
解答 解:(1)二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水,化学方程式为:4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)浓盐酸具有挥发性,A制取的氯气中混有氯化氢,氯化氢易溶于水,氯气在饱和食盐水中的溶解度不大,所以可以用C吸收HCl;
故答案为:除去氯气中的氯化氢;
(3)要制取干燥的氯气应用浓硫酸吸收氯气中的水蒸气,
故答案为:浓硫酸;
(4)氯气有毒,不能够直接排放,氯气能够与氢氧化钠反应,被氢氧化钠溶液吸收,
故答案为:缺少尾气处理装置;应用NaOH溶液吸收多余的氯气.
点评 本题考查氯气的制备和性质,明确实验的目的与反应的原理是解题的关键,注意二氧化锰只能够氧化浓盐酸,与稀盐酸不反应.

练习册系列答案
相关题目
13.下列关于平衡常数的说法中,正确的是( )
| A. | 化学平衡常数用来定量描述化学反应的限度 | |
| B. | 利用化学平衡常数判断化学反应进行的快慢 | |
| C. | 平衡常数的大小与温度、浓度、压强、催化剂有关 | |
| D. | 对于一个化学反应达到平衡之后,若只改变一个因素使得平衡发生移动,则K值一定变化 |
11.下列过程一定有化学变化发生的是( )
| A. | 淀粉水解 | B. | 酒精挥发 | C. | 水结成冰 | D. | 碘的升华 |
18.下列属于电解质是( )
| A. | 淀粉 | B. | KNO3溶液 | C. | 乙醇 | D. | 熔融的NaCl |
8.化合物HIn在水溶液中因存在以下电离平衡:HIn(红色)?H++In-(黄色) 故可用作酸碱指示剂,浓度为0.02mol•L-1的下列各溶液:①盐酸 ②石灰水 ③NaCl溶液 ④NaHSO4溶液 ⑤Na2CO3溶液 ⑥氨水 ⑦AlCl3溶液,其中能使指示剂显红色的是( )
| A. | ②⑤⑥ | B. | ①④⑤ | C. | ①④⑦ | D. | ①④⑤⑦ |
12.合成氨反应为N2+3H2≒2NH3,今有A、B、C、D四个容器,每个容器中有两种操作,两种操作分别达到平衡后,操作1中N2和操作2中NH3转化率之和一定不为1的是(起始体积相等)( )
| A. | 恒温恒容:操作1:加1mol N2+3mol H2,操作2:加2mol NH3 | |
| B. | 恒温恒压:操作1:加1mol N2+3mol H2,操作2:加2mol NH3 | |
| C. | 恒温恒容:操作1:加1mol N2+3mol H2,操作2:加3mol NH3 | |
| D. | 恒温恒压:操作1:加1mol N2+3mol H2,操作2:加3mol NH3 |