题目内容
(1)甲烷是一种重要的清洁能源,请写出以KOH溶液为电解质溶液,甲烷燃料电池的正极反应式:____。 (2)电解原理在化学工业中有广泛的应用。图中a为电解液,X和Y是两块电极板,则:
①若X和Y分别为铁和石墨,a为饱和食盐水,则电解时X电极反应式为______________。
②若X、Y分别为石墨和铁,a为饱和食盐水,则电解过程中生成的白色固体露置 在空气中,可观察到的现象是___________。
①若X和Y分别为铁和石墨,a为饱和食盐水,则电解时X电极反应式为______________。
②若X、Y分别为石墨和铁,a为饱和食盐水,则电解过程中生成的白色固体露置 在空气中,可观察到的现象是___________。

(3)高纯铜(纯度可达99. 99%)广泛应用于电器工业。某粗铜样品中含Fe、Ni、 Ag、Au等四种金属杂质,可用电解法进行精炼制得高纯铜。电解完毕后,某兴趣小组欲对电解溶液中的离子进行分离,他们通过查阅资料,得知相关氢氧化物在不同pH下的溶解度曲线如上图。
①结合图分析,相同温度下Ksp[Cu(OH)2]、Ksp[Ni(OH)2]、Ksp[Fe(OH)2]由大到小的顺序为_________。
②分离过程中,使上述溶液的pH逐渐增加,则溶液中的Cu2+ 、Fe3+和Ni2+沉淀的先后顺序依次为____________(填写离子符号)。
①结合图分析,相同温度下Ksp[Cu(OH)2]、Ksp[Ni(OH)2]、Ksp[Fe(OH)2]由大到小的顺序为_________。
②分离过程中,使上述溶液的pH逐渐增加,则溶液中的Cu2+ 、Fe3+和Ni2+沉淀的先后顺序依次为____________(填写离子符号)。
(1)O2+2H2O+4e-=4OH-
(2)①2H++2e-=H2↑ ;②白色固体迅速变灰绿色,最终变成红褐色
(3)①Kap[Fe(OH)2]>Kap[Ni(OH)2]> Kap [Cu(OH)2] ;②Fe3+ .Cu2+ .Fe2+
(2)①2H++2e-=H2↑ ;②白色固体迅速变灰绿色,最终变成红褐色
(3)①Kap[Fe(OH)2]>Kap[Ni(OH)2]> Kap [Cu(OH)2] ;②Fe3+ .Cu2+ .Fe2+

练习册系列答案
相关题目
甲烷是一种重要的基础化工原料,不仅可制备多种重要有机产品,还可用于环境保护.请回答下列问题:(1)用甲烷催化还原氮的氧化物可消除氮氧化物的污染.已知:
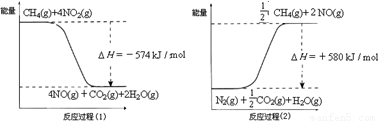
反应过程(2)是 反应(填“放热”或“吸热”),甲烷还原NO2生成H2O(g)、N2和CO2时的热化学方程式是 .
(2)工厂利用甲烷与氯气的反应原理制取氯甲烷,为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应:
CCl4(g)+H2(g)?CHCl3(g)+HCl(g),使CCl4转化为重要的化工原料氯仿(CHCl3)(不考虑副反应).
在固定容积为2L的密闭容器中,该反应达到平衡后,测得如下数据:
①此反应在110℃时平衡常数为 . ②实验l中,CCl4的转化率为 .
③判断该反应的正反应是 (填“放热”或“吸热”),理由是 .
④为提高实验3中CCl4的转化率,可采取的措施是 .
a.使用高效催化剂 b.向容器中再投入1mol CCl4和1mol H2
c.温度升高到200℃d.向容器中再投入1mol HCl e.向容器中再投入1mol H2.

反应过程(2)是 反应(填“放热”或“吸热”),甲烷还原NO2生成H2O(g)、N2和CO2时的热化学方程式是 .
(2)工厂利用甲烷与氯气的反应原理制取氯甲烷,为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应:
CCl4(g)+H2(g)?CHCl3(g)+HCl(g),使CCl4转化为重要的化工原料氯仿(CHCl3)(不考虑副反应).
在固定容积为2L的密闭容器中,该反应达到平衡后,测得如下数据:
| 实验 序号 | 温度℃ | 初始n(CCl4) (mol) | 初始n(H2) (mol) | 平衡时n(CHCl3) (mol) |
| 1 | 110 | 0.8 | 1.2 | |
| 2 | 110 | 2 | 2 | 1 |
| 3 | 100 | 1 | 1 | 0.6 |
③判断该反应的正反应是 (填“放热”或“吸热”),理由是 .
④为提高实验3中CCl4的转化率,可采取的措施是 .
a.使用高效催化剂 b.向容器中再投入1mol CCl4和1mol H2
c.温度升高到200℃d.向容器中再投入1mol HCl e.向容器中再投入1mol H2.