题目内容
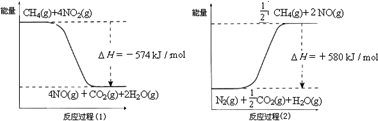
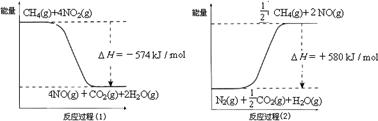
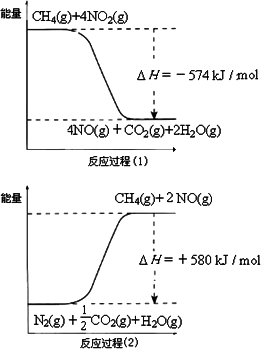
甲烷是一种重要的基础化工原料,不仅可制备多种重要有机产品,还可用于环境保护.请回答下列问题:(1)用甲烷催化还原氮的氧化物可消除氮氧化物的污染.已知: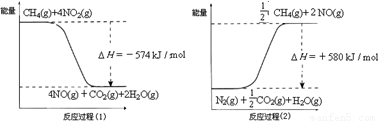
反应过程(2)是 反应(填“放热”或“吸热”),甲烷还原NO2生成H2O(g)、N2和CO2时的热化学方程式是 .
(2)工厂利用甲烷与氯气的反应原理制取氯甲烷,为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应:
CCl4(g)+H2(g)?CHCl3(g)+HCl(g),使CCl4转化为重要的化工原料氯仿(CHCl3)(不考虑副反应).
在固定容积为2L的密闭容器中,该反应达到平衡后,测得如下数据:
| 实验 序号 | 温度℃ | 初始n(CCl4) (mol) | 初始n(H2) (mol) | 平衡时n(CHCl3) (mol) |
| 1 | 110 | 0.8 | 1.2 | |
| 2 | 110 | 2 | 2 | 1 |
| 3 | 100 | 1 | 1 | 0.6 |
③判断该反应的正反应是 (填“放热”或“吸热”),理由是 .
④为提高实验3中CCl4的转化率,可采取的措施是 .
a.使用高效催化剂 b.向容器中再投入1mol CCl4和1mol H2
c.温度升高到200℃d.向容器中再投入1mol HCl e.向容器中再投入1mol H2.
【答案】分析:(1)根据反应物和生成物总能量的相对大小来判断;根据反应过程(1)、反应过程(2)写出对应的热化学方程式,利用盖斯定律来解;
(2)①先根据平衡三部曲计算出各物质的平衡浓度,再根据平衡常数的公式计算;
②先根据①的平衡常数利用平衡三部曲计算出各物质的平衡浓度,再根据转化率的公式计算;
③根据不同温度下的平衡常数来判断;
④根据外界条件对化学平衡的影响来解答.
解答:解:(1)反应物总能量小于生成物总能量,所以反应吸热,故答案为:吸热;
反应过程(1)的热化学方程式:CH4(g)+4NO2(g)=CO2(g)+4NO(g)+2H2O(g)△H=-574kJ/mol ①,
反应过程(2)的热化学方程式:CH4(g)+4NO(g)=CO2(g)+2N2(g)+2H2O(g)△H=-1160kJ/mol ②,
①+②得:2CH4(g)+4NO2(g)=2CO2(g)+2N2(g)+4H2O(g)△H=-1734 kJ/mol,
故答案为:2CH4(g)+4NO2(g)=2CO2(g)+2N2(g)+4H2O(g)△H=-1734 kJ/mol;
(2)①CCl4(g)+H2(g)?CHCl3(g)+HCl(g),
起始(mol/L ) 1 1 0 0
反应(mol/L ) 0.5 0.5 0.5 0.5
平衡(mol/L) 0.5 0.5 0.5 0.5
则平衡常数为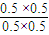 =1,故答案为:1;
=1,故答案为:1;
②CCl4(g)+H2(g)?CHCl3(g)+HCl(g),
起始(mol/L ) 0.4 0.6 0 0
反应(mol/L ) a a a a
平衡(mol/L) 0.4-a 0.6-a a a
则平衡常数为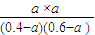 =1,所以a=0.24,则CCl4的转化率为
=1,所以a=0.24,则CCl4的转化率为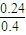 ×100%=60%,故答案为:60%;
×100%=60%,故答案为:60%;
③CCl4(g)+H2(g)?CHCl3(g)+HCl(g),
起始(mol/L ) 0.5 0.5 0 0
反应(mol/L ) 0.3 0.3 0.3 0.3
平衡(mol/L) 0.2 0.2 0.3 0.3
则平衡常数为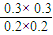 =2.25,
=2.25,
因温度升高,平衡常数减小,说明化学平衡逆向移动;所以正反应放热,
故答案为:放热;温度为100℃时,K=2.25,大于110℃时的平衡常数,所以该反应为放热反应;
④a.使用高效催化剂,平衡不移动,CCl4的转化率不变,故a错误;
b.向容器中再投入1mol CCl4和1molH2,根据等效平衡,化学平衡不移动,CCl4的转化率不变,故b错误;
c.温度升高到200℃,平衡逆向移动,CCl4的转化率减小,故c错误;
d.向容器中再投入1molHCl,平衡逆向移动,CCl4的转化率减小,故d错误;
e.向容器中再投入1molH2,平衡正向移动,CCl4的转化率增大,故e错误;
故选:e.
点评:本题主要考查了热化学方程式、化学平衡常数、转化率、化学平衡移动,难度不大.
(2)①先根据平衡三部曲计算出各物质的平衡浓度,再根据平衡常数的公式计算;
②先根据①的平衡常数利用平衡三部曲计算出各物质的平衡浓度,再根据转化率的公式计算;
③根据不同温度下的平衡常数来判断;
④根据外界条件对化学平衡的影响来解答.
解答:解:(1)反应物总能量小于生成物总能量,所以反应吸热,故答案为:吸热;
反应过程(1)的热化学方程式:CH4(g)+4NO2(g)=CO2(g)+4NO(g)+2H2O(g)△H=-574kJ/mol ①,
反应过程(2)的热化学方程式:CH4(g)+4NO(g)=CO2(g)+2N2(g)+2H2O(g)△H=-1160kJ/mol ②,
①+②得:2CH4(g)+4NO2(g)=2CO2(g)+2N2(g)+4H2O(g)△H=-1734 kJ/mol,
故答案为:2CH4(g)+4NO2(g)=2CO2(g)+2N2(g)+4H2O(g)△H=-1734 kJ/mol;
(2)①CCl4(g)+H2(g)?CHCl3(g)+HCl(g),
起始(mol/L ) 1 1 0 0
反应(mol/L ) 0.5 0.5 0.5 0.5
平衡(mol/L) 0.5 0.5 0.5 0.5
则平衡常数为
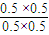 =1,故答案为:1;
=1,故答案为:1; ②CCl4(g)+H2(g)?CHCl3(g)+HCl(g),
起始(mol/L ) 0.4 0.6 0 0
反应(mol/L ) a a a a
平衡(mol/L) 0.4-a 0.6-a a a
则平衡常数为
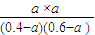 =1,所以a=0.24,则CCl4的转化率为
=1,所以a=0.24,则CCl4的转化率为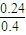 ×100%=60%,故答案为:60%;
×100%=60%,故答案为:60%; ③CCl4(g)+H2(g)?CHCl3(g)+HCl(g),
起始(mol/L ) 0.5 0.5 0 0
反应(mol/L ) 0.3 0.3 0.3 0.3
平衡(mol/L) 0.2 0.2 0.3 0.3
则平衡常数为
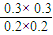 =2.25,
=2.25,因温度升高,平衡常数减小,说明化学平衡逆向移动;所以正反应放热,
故答案为:放热;温度为100℃时,K=2.25,大于110℃时的平衡常数,所以该反应为放热反应;
④a.使用高效催化剂,平衡不移动,CCl4的转化率不变,故a错误;
b.向容器中再投入1mol CCl4和1molH2,根据等效平衡,化学平衡不移动,CCl4的转化率不变,故b错误;
c.温度升高到200℃,平衡逆向移动,CCl4的转化率减小,故c错误;
d.向容器中再投入1molHCl,平衡逆向移动,CCl4的转化率减小,故d错误;
e.向容器中再投入1molH2,平衡正向移动,CCl4的转化率增大,故e错误;
故选:e.
点评:本题主要考查了热化学方程式、化学平衡常数、转化率、化学平衡移动,难度不大.

练习册系列答案
相关题目

 CHCl3(g)+HCl(g),
CHCl3(g)+HCl(g),