题目内容
【题目】已知A~K均为中学化学中的常见物质,它们之间的转化关系如下图所示,其中A、D为金属单质,反应过程中生成的水及其他部分产物已略去。
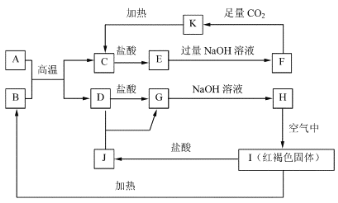
请回答以下问题:
(1)C________H________F (填化学式)
(2)A与B在高温下反应的化学方程式为 。
(3)H变成I的化学方程式是 。
(4)向F中通入足量CO2生成K的离子方程式为 。
(5)D+J生成G的离子方程式为 。
[
【答案】(11分)
(1)C Al2O3 H Fe(OH)2 F NaAlO2 (3分)
(2)2Al+Fe2O3![]() Al2O3+2Fe (2分)
Al2O3+2Fe (2分)
(3)4Fe(OH)2+O2+2H2O==4Fe(OH)3 (2分)
(4)CO2+AlO2-+2H2O==Al(OH)3 ↓+HCO3- (2分)
(5)2Fe3++Fe==3Fe2+ (2分)
【解析】
试题分析:I为红褐色固体,则I为Fe(OH)3;依据转化关系中的现象分析判断,H为Fe(OH)2;氢氧化铁加热生成的B为Fe2O3,依据J是氢氧化铁和盐酸反应生成的氯化铁,判断D为铁,G为FeCl2,依据A+B在高温下反应判断,A为Al,D为Fe,C为Al2O3,K加热生成氧化铝,说明K为Al(OH)3,E为AlCl3,F为NaAlO2;由此分析可知:
(1)C为Al2O3,H为Fe(OH)2,F为NaAlO2,故答案为:C: Al2O3,H:Fe(OH)2,F: NaAlO2;
(2)A为Al,B为Fe2O3,A与B在高温下反应的化学方程式为:2Al+Fe2O3![]() Al2O3+2Fe;
Al2O3+2Fe;
(3)Fe(OH)2变成Fe(OH)3的化学方程式是:4Fe(OH)2+O2+2H2O==4Fe(OH)3;
(4)向 NaAlO2中通入足量CO2生成Al(OH)3的离子方程式为CO2+AlO2-+2H2O==Al(OH)3↓+HCO3-;
(5)D+J生成G的离子方程式为2Fe3++Fe==3Fe2+

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案