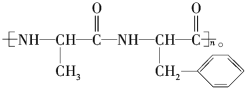
题目内容
【题目】有一包白色固体粉末,由Na2SO4、CaCO3、KCl、BaCl2、CuSO4中的三种物质组成,取样进行如下实验:
I.取少量白色粉末,加入足量水,充分搅拌后过滤,得到白色沉淀和无色滤液;
II.向I中滤出的沉淀中加入足量稀盐酸,沉淀全溶解,并生产无色气体。
(1)则原混合物中一定不存在 ,一定存在 。
(2)实验中发生反应的化学方程式: 。
(3)设计实验进一步确定混合物的组成,简述实验步骤、现象和结论。 。
【答案】(1)CuSO4 CaCO3 KCl(2)CaCO3 + 2HCl![]() CaCl2 + CO2 + H2O↑
CaCl2 + CO2 + H2O↑
(3)用试管取适量I过滤得到的无色溶液,加入少量BaCl2 溶液,若产生沉淀则白色固体组成中有Na2SO4 ,否则白色固体组成中有BaCl2
【解析】(1)固体粉末加到水中,得到白色沉淀,且上层清液为无色,说明粉末中一定没有硫酸铜,白色沉淀可能是碳酸钙或硫酸钠与氯化钡反应产生的硫酸钡;白色沉淀完全溶于稀盐酸,说明沉淀为碳酸钙,说明硫酸钠和氯化钡不能同时存在,因此一定含有碳酸钙、氯化钾,而硫酸钠和氯化钡含有其中之一。(2)实验中的反应为碳酸钙和盐酸反应生成氯化钙和水和二氧化碳。(3)要进一步确定混合物中是否含有硫酸钠或氯化钡,操作为:用试管取适量I过滤得到的无色溶液,加入少量BaCl2 溶液,若产生沉淀则白色固体组成中有Na2SO4 ,否则白色固体组成中有BaCl2 。

 阅读快车系列答案
阅读快车系列答案【题目】正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.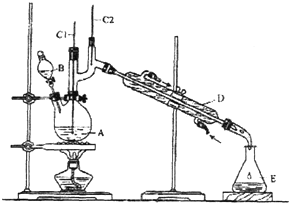
发生的反应如下:
CH3CH2CH2CH2OH ![]() CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(gcm﹣3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90﹣95℃,在E中收集90℃以下的馏分.将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75﹣77℃馏分,产量2.0g.回答下列问题:
(1)上述装置图中,B仪器的名称是 , D仪器的名称是;
(2)加入沸石的作用是;
(3)分液漏斗使用前必须进行的操作是 (填正确答案标号);
a.润湿 b.干燥 c.检漏 d.标定
(4)将正丁醛粗产品置于分液漏斗中分水时,水在层(填“上”或“下”)
(5)反应温度应保持在90﹣95℃.其原因是
(6)本实验中,正丁醛的产率为 %.