题目内容
【题目】实验小组为探究SO2的漂白性和还原性,设计了以下实验.完成下列填空:
(1)实验室用亚硫酸钠粉末跟硫酸制取二氧化硫,有下列三种硫酸溶液,应选用(选填编号),其理由是 . a.98%浓硫酸 b.70%硫酸 c.10%稀硫酸
(2).漂白性用如图所示装置(气密性良好)进行实 验,观察到如下现象:ⅰ中红色褪去、ⅱ中无变化.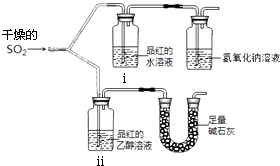
①足量碱石灰的作用是 .
②从实验中可知使品红的水溶液褪色的 微粒可能是 .
(3)实验小组进一步实验如下:取等量相同浓度的品红水溶液于两支试管中,再分别加入少量Na2SO3固体和NaHSO3固体,两支试管中的品红都褪色,于是得出结论:使品红褪色的微粒肯定是HSO ![]() 或SO
或SO ![]() .你认为这一结论是否正确 , 理由是 .
.你认为这一结论是否正确 , 理由是 .
(4).还原性将SO2通入FeCl3溶液中,使其充分反应.
①SO2与FeCl3反应的离子方程式是 , 如何检验该反应所得含氧酸根离子 .
②实验中观察到溶液由黄色变为红棕色,静置一段时间,变为浅绿色.
已知:红棕色为FeSO3(墨绿色难溶物)与FeCl3溶液形成的混合色;Fe3+可氧化SO32﹣ .
则②中红棕色变为浅绿色的原因是 .
【答案】
(1)b;98%浓硫酸中c(H+)小不易反应,10%硫酸溶液水含量高不易使SO2放出
(2)防止空气中的水蒸气进入ⅱ中干扰实验,吸收二氧化硫防污染;H2SO3、HSO ![]() 、SO
、SO ![]()
(3)不正确;因为SO ![]() 离子和HSO3﹣离子都会水解生成H2SO3
离子和HSO3﹣离子都会水解生成H2SO3
(4)2Fe3++SO2+2H2O=2Fe2++SO ![]() +4H+;取少量反应混合液,加入盐酸酸化后加氯化钡溶液,产生白色沉淀,混合液中即含有SO
+4H+;取少量反应混合液,加入盐酸酸化后加氯化钡溶液,产生白色沉淀,混合液中即含有SO ![]() ;混合液中存在平衡FeSO3(s)?Fe2+(aq)+SO
;混合液中存在平衡FeSO3(s)?Fe2+(aq)+SO ![]() (aq),Fe3+会与SO
(aq),Fe3+会与SO ![]() 发生氧化还原反应,使平衡右移,墨绿色沉淀溶解,最终生成浅绿色FeSO4溶液
发生氧化还原反应,使平衡右移,墨绿色沉淀溶解,最终生成浅绿色FeSO4溶液
【解析】解:(1).硫酸和亚硫酸钠固体制取二氧化硫发生的是离子反应,98%浓硫酸中硫酸是以分子形式存在,c(H+)小不易反应,10%硫酸溶液水含量高,二氧化硫易溶于水,不易使SO2放出,所以选取70%硫酸,故答案为:b;98%浓硫酸中c(H+)小不易反应,10%硫酸溶液水含量高不易使SO2放出(2)①实验目的是验证干燥的二氧化硫能否漂白品红,应避免空气中水蒸气加入,SO2对环境有污染,需要吸收处理,故碱石灰的作用是防止空气中的水蒸气进入ⅱ中干扰实验,吸收二氧化硫防污染,
故答案为:防止空气中的水蒸气进入ⅱ中干扰实验,吸收二氧化硫防污染;
②SO2不能使口红褪色,而其水溶液可以,因此使品红褪色的微粒可能是H2SO3、HSO ![]() 、SO
、SO ![]() ,
,
故答案为:H2SO3、HSO ![]() 、SO
、SO ![]() ;(3)亚硫酸钠和亚硫酸氢钠都能水解生成亚硫酸,且亚硫酸氢根离子能电离生成亚硫酸根离子,所以两种溶液中都含有HSO
;(3)亚硫酸钠和亚硫酸氢钠都能水解生成亚硫酸,且亚硫酸氢根离子能电离生成亚硫酸根离子,所以两种溶液中都含有HSO ![]() 、SO
、SO ![]() 、H2SO3 , 所以不能确定使品红褪色的微粒肯定是HSO
、H2SO3 , 所以不能确定使品红褪色的微粒肯定是HSO ![]() 或SO
或SO ![]() ,
,
故答案为:不正确,因为SO ![]() 离子和HSO
离子和HSO ![]() 离子都会水解生成H2SO3;(4)①SO2与FeCl3反应的离子方程式是:2Fe3++SO2+2H2O=2Fe2++SO
离子都会水解生成H2SO3;(4)①SO2与FeCl3反应的离子方程式是:2Fe3++SO2+2H2O=2Fe2++SO ![]() +4H+ , 检验SO42﹣的方法是:取少量反应混合液,加入盐酸酸化后加氯化钡溶液,产生白色沉淀,混合液中即含有SO42﹣ ,
+4H+ , 检验SO42﹣的方法是:取少量反应混合液,加入盐酸酸化后加氯化钡溶液,产生白色沉淀,混合液中即含有SO42﹣ ,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+;取少量反应混合液,加入盐酸酸化后加氯化钡溶液,产生白色沉淀,混合液中即含有SO ![]() ;
;
②混合液中存在平衡FeSO3(s)Fe2+(aq)+SO (aq),Fe3+会与SO32﹣发生氧化还原反应,使平衡右移,墨绿色沉淀溶解,最终生成浅绿色FeSO4溶液,
故答案为:混合液中存在平衡FeSO3(s)Fe2+(aq)+SO ![]() (aq),Fe3+会与SO32﹣发生氧化还原反应,使平衡右移,墨绿色沉淀溶解,最终生成浅绿色FeSO4溶液.
(aq),Fe3+会与SO32﹣发生氧化还原反应,使平衡右移,墨绿色沉淀溶解,最终生成浅绿色FeSO4溶液.
(1)硫酸和亚硫酸钠固体制取二氧化硫发生的是离子反应,如果硫酸浓度过大,硫酸是以分子形式存在,电离出H+很少,不能反应生成SO2 , 如果硫酸浓度过低,二氧化硫易溶于水,不利于二氧化硫放出;(2)①实验目的是验证干燥的二氧化硫能否漂白品红,应避免空气中水蒸气加入,SO2对环境有污染,需要尾气处理;
②SO2不能使品红的乙醇溶液褪色,而其水溶液可以,使品红褪色的微粒含有S元素;(3)亚硫酸钠和亚硫酸氢钠都能水解生成亚硫酸,且亚硫酸氢根离子能电离生成亚硫酸根离子,所以两种溶液中都含有HSO ![]() 、SO
、SO ![]() 、H2SO3;(4)①铁离子具有强氧化性,在溶液中可以将二氧化硫氧化为硫酸根;利用盐酸酸化的氯化钡溶液检验硫酸根离子;
、H2SO3;(4)①铁离子具有强氧化性,在溶液中可以将二氧化硫氧化为硫酸根;利用盐酸酸化的氯化钡溶液检验硫酸根离子;
②混合液中存在平衡FeSO3(s)Fe2+(aq)+SO ![]() (aq),Fe3+会与SO
(aq),Fe3+会与SO ![]() 发生氧化还原反应,使平衡右移,最终生成FeSO4溶液.
发生氧化还原反应,使平衡右移,最终生成FeSO4溶液.