题目内容
【题目】如图方框中的每一字母各代表一种物质或溶液,它们在一定条件下发生反应的关系如图1(图中略去了一些物质).已知A、D是两种常见的金属,B是红棕色金属氧化物,C是一种熔点很高的金属氧化物.
根据示意图回答下列问题:
(1)写出下列物质的化学式:B , K;
(2)写出H→G的离子方程式;
(3)写出N→M化学方程式;
(4)实验室在配制H的溶液时,往往要加入少量的D,其作用是 .
(5)检验G中的阳离子的常用方法和现象是 .
(6)取图1中一定量F溶液,向其中逐滴加入NaOH溶液直至过量.如图2所示示意图能表示实验过程中沉淀的质量随NaOH溶液体积变化的是(填序号) . 
【答案】
(1)Fe2O3;Al(OH)3
(2)2Fe2++H2O2+2H+=2Fe3++2H2O
(3)4Fe(OH)2+O2+2H2O=4Fe(OH)3
(4)防止Fe2+被氧化为Fe3+
(5)取少量H溶液,加入几滴KSCN溶液,溶液显红色
(6)⑤
【解析】解:A、D是两种常见的金属,B是红棕色金属氧化物,A与B反应生成D与C,C是一种熔点很高的金属氧化物,既能与盐酸反应又能与氢氧化钠反应,可推知A为Al、B为Fe2O3、D为Fe、C为Al2O3 , 由转化关系可知,F为AlCl3 , E为NaAlO2 , K为Al(OH)3 , H为FeCl2 , G为FeCl3 , N为Fe(OH)2 , M为Fe(OH)3 , 氢氧化铁加热分解得到氧化铁.(1)由上述分析可知,B为Fe2O3 , K为Al(OH)3 , 所以答案是:Fe2O3;Al(OH)3;(2)H→G的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O,所以答案是:2Fe2++H2O2+2H+=2Fe3++2H2O;(3)N→M化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3 , 所以答案是:4Fe(OH)2+O2+2H2O=4Fe(OH)3;(4)实验室在配制FeCl2的溶液时,往往要加入少量的Fe,其作用是:防止Fe2+被氧化为Fe3+ , 所以答案是:防止Fe2+被氧化为Fe3+;(5)检验FeCl3中的阳离子的常用方法和现象是:取少量H溶液,加入几滴KSCN溶液,溶液显红色,所以答案是:取少量H溶液,加入几滴KSCN溶液,溶液显红色;(6)取一定量AlCl3溶液(含有属于的盐酸),向其中逐滴加入NaOH溶液直至过量,开始氢氧化钠中和剩余的盐酸,没有沉淀生成,然后发生反应:AlCl3+3NaOH=Al(OH)3↓+3NaCl,生成氢氧化铝沉淀,而后又发生:Al(OH)3+NaOH=NaAlO2+2H2O,前后生成沉淀与沉淀溶解消耗氢氧化钠的体积之比为3:1,图象中⑤符合,所以答案是:⑤.

 智慧小复习系列答案
智慧小复习系列答案【题目】甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料. 已知:
①2H2(g)+O2(g)═2H2O(l)△H1=﹣571.6kJmol﹣1
②CH4(g)+ ![]() O2(g)═CO(g)+2H2(g)△H2=﹣36kJmol﹣1
O2(g)═CO(g)+2H2(g)△H2=﹣36kJmol﹣1
③CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+216kJmol﹣1
(1)氢气的燃烧热为 , 写出甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式: .
(2)现有1mol由H2O(g)与O2组成的混合气体,且O2的体积分数为x,将此混合气体与足量CH4充分反应.当x=时,反应②与③放出(或吸收)的总能量为0.若②反应过程中能量转化过程如图所示,下列有关说法中正确的是 . 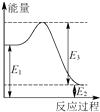
A.E1=36kJ B.E2=36kJ C.E1﹣E2=36kJ D.E3﹣E1=36kJ
(3)工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)=CH3OH(g)△H1(CO结构式为C≡O).又知某些化学键的键能(断开1mol化学键时所需要的最低能量)数值如表:
化学键 | C﹣C | C﹣H | H﹣H | C﹣O | C≡O | H﹣O |
键能 | 348 | 413 | 436 | 358 | 1072 | 463 |
则△H1= .
【题目】[化学--选修3:物质结构与性质]锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar] , 有个未成对电子.
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键.从原子结构角度分析,原因是 .
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因 .
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | ﹣49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂.Zn、Ge、O电负性由大至小的顺序是 .
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为 , 微粒之间存在的作用力是 .
(6)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0, ![]() );C为(
);C为( ![]() ,
, ![]() ,0).则D原子的坐标参数为 .
,0).则D原子的坐标参数为 . 
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76pm,其密度为 gcm﹣3(列出计算式即可).



