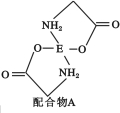
��Ŀ����
����Ŀ���±��������ֶ�����Ԫ�ص������Ϣ��
Ԫ�� | �����Ϣ |
A | ���¡���ѹ�£��䵥������������壬������Ϊ�������������ȼ�� |
B | ��ҵ��ͨ������Һ̬��������䵥�ʣ���ij��ͬ���������DZ�������ر���������Ҫ���� |
C | ֲ��������Ҫ��֮һ�������γɶ��������ijЩ���������ɹ⻯ѧ��Ⱦ |
D | �������䵥��Ϊ����ɫ��ĩ״���壬�������ۻ����õ�����������ȼ�գ���������������ɫ���� |
E | �������䵥��Ϊ����ɫ���壬�䵥��ˮ��Һ��Ư�ס�ɱ������ |
�밴Ҫ��ش��������⣺
��1��DԪ�غ�������Ų� ��
��2��A��B��Ԫ���γɵĺ��зǼ��Լ��Ļ�����Ľṹʽ ��A��B��Ԫ���γɵľ�����ͬ�������������У��ѧʽ����______________��_____________��
��3��C��A�γɵ�ijһ�������ܺ�C��B�γɵ���һ��ɫ�������������ֻ����������ԭ�Ӹ����Ƚ�Ϊ1��2��һ������������Ƽ������߷�����Ӧ���������ʣ�д��������ѧ��Ӧ����ʽ�� ��
��4��һ�������£���ˮ��Һ��1 mol E����EO��x��1,2,3,4����������kJ����Դ�С��ͼ��ʾ��n�� �������ӷ����������ӷ�Ӧy��x��m���Ȼ�ѧ����ʽΪ ��

��5��Na2DB3ˮ��Һ�и�����Ũ�ȵĴ�С˳���� �������ӷ��ţ���
���𰸡���1�� ![]() ��1�֣�
��1�֣�
��2��H-O-O-H��2�֣��� OH����2�֣���H3O+��2�֣�
��3��2N2H4+N2O4==3N2+4H2O ��2�֣���4��ClO4����1�֣� ��
3ClO����aq�� = 2Cl����aq�� +ClO3����aq�� ��H����117 kJ��mol-1��2�֣�
��5��Na+��SO32-��OH-��HSO3-��H+��2�֣�
��������
���������A��B��C��DΪ������Ԫ�أ�������ȼ�ղ���Ϊˮ���DZ������������ȼ�ϣ���AΪH������Һ̬�����ɵõ������������������ܱ�������ر���������BΪO��C��ֲ���������ֱ���Ԫ��֮һ�������γɶ�������������γɶ�����������⻯������ѧ��ѧ��ѧϰ��Ψһ�ļ������壬��ʹʪ��ĺ�ɫʯ����ֽ��������CΪN��������D�ĵ��ʳʷ�ĩ״���壬�������ۻ����õ�����������ȼ�գ���������������ɫ���棬��DΪS��E�������䵥��Ϊ����ɫ���壬�䵥��ˮ��Һ��Ư�ס�ɱ�����ã���EΪCl����1��DΪS����������Ų�![]() ����2��A��B��Ԫ���γɵĺ��зǼ��Լ��Ļ�����������⣬��ṹʽΪH-O-O-H���⡢����Ԫ���γɵľ�����ͬ��������������OH-��H3O+����3���������γɵ�ijһ������N2H4�ܺ͵������γɵ���һ��ɫ������N2O4�����߷�����Ӧ�����������ǵ�������Ӧ����ʽΪ��2N2H4+N2O4�T3N2+4H2O����4��n����+7�۵����ӷ���Ϊ��ClO4-�����ӷ�Ӧy��x+m��y��������������ԭ��Ӧ����x��m������ת�Ƶ����غ�ø÷�Ӧ����ʽΪ3ClO-=ClO3-+2Cl-����Ӧ��=��63kJ/mol+2��0kJ/mol��-3��60kJ/mol=-117kJ/mol����5��Na2SO3ˮ��Һ�ʼ��ԣ���Һ�и�����Ũ�ȵĴ�С˳����Na+��SO32-��OH-��HSO3-��H+��
����2��A��B��Ԫ���γɵĺ��зǼ��Լ��Ļ�����������⣬��ṹʽΪH-O-O-H���⡢����Ԫ���γɵľ�����ͬ��������������OH-��H3O+����3���������γɵ�ijһ������N2H4�ܺ͵������γɵ���һ��ɫ������N2O4�����߷�����Ӧ�����������ǵ�������Ӧ����ʽΪ��2N2H4+N2O4�T3N2+4H2O����4��n����+7�۵����ӷ���Ϊ��ClO4-�����ӷ�Ӧy��x+m��y��������������ԭ��Ӧ����x��m������ת�Ƶ����غ�ø÷�Ӧ����ʽΪ3ClO-=ClO3-+2Cl-����Ӧ��=��63kJ/mol+2��0kJ/mol��-3��60kJ/mol=-117kJ/mol����5��Na2SO3ˮ��Һ�ʼ��ԣ���Һ�и�����Ũ�ȵĴ�С˳����Na+��SO32-��OH-��HSO3-��H+��

 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�����Ŀ����2016����ɽ��ģ������������һ�ֹ�ҵ�Σ������ʳ�ηdz����ƣ����Խ�ǿ��ij��ѧ��ȤС���ʳ�����������ƽ��ж�Ƕ�̽����
��һ������NaCl��NaNO2
��ͬѧ�ó���������
���飺������Ksp(AgNO2)=2��10-8�� Ksp(AgCl)=1.8��10-10���ֱ���ʢ��5mL 0.0001 mol/L��������Һ���Ժ���ͬʱ��εμ�0.0001mol/L��������Һ�������ɳ�������װ�� ��Һ���Թܡ�
��ͬѧ�ඨ��ҺpH
��pH��ֽ�ֱ�ⶨ0.1 mol/L��������Һ��pH�����NaNO2��Һ�ʼ��ԡ�����Һ�ʼ��Ե�ԭ���� �������ӷ���ʽ���ͣ���
��������С��������װ�ã���ȥ�г��������Ʊ���������

��֪���� 2NO+ Na2O2 = 2NaNO2 ��
�� ���������£�NO��NO2������MnO4һ��Ӧ����NO3һ��Mn2+��
��1��ʹ��ͭ˿���ŵ��� ��
��2��װ��A�з�Ӧ����ʽΪ ��
װ��C ��ʢ�ŵ�ҩƷ�� ��������ĸ���ţ�
A��Ũ���� B��NaOH ��Һ C��ˮ D�����Ȼ�̼
����F������ ��
��3����С���ȡ5.000g��ȡ����Ʒ����ˮ���250.0 mL��Һ��ȡ25.00mL��Һ����ƿ�У���0.1000mol/L����KMnO4��Һ���еζ���ʵ�������������±���ʾ��
����� | 1 | 2 | 3 | 4 |
����KMnO4��Һ���/mL | 20.70 | 20.12 | 20.00 | 19.88 |
�� ��һ��ʵ�����ݳ����쳣����������쳣��ԭ������� ������ĸ���ţ���
A����ƿϴ����δ����
B����ʽ�ζ���������ˮϴ����δ�ñ�Һ��ϴ
C���ζ��յ�ʱ���Ӷ���
������KMnO4��Һ�ζ�����������Һ�����ӷ���ʽΪ ��
������Ʒ���������Ƶ���������Ϊ ��