题目内容
【题目】(1)铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:
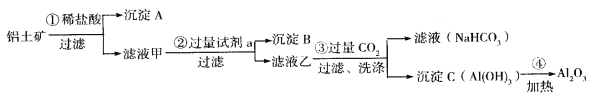
①沉淀A成分是____________;步骤②中的试剂a是_________;(以上均填化学式)。
②简述检验所得滤液甲中存在Fe3+的操作方法:________________________。
(2)用含少量铁的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作:

已知:在pH为4~5时,Fe3+几乎完全转化为Fe(OH)3沉淀,Cu2+却不反应。
①氧化剂A可选用_________________(填编号,下同)。
A KMnO4 B HNO3 C Cl2 D 浓盐酸
②试剂B可选用____________________。
A NaOH B CuO C FeO D HCl
③试剂B的作用是_______________________________。
A 使Cu2+完全沉淀 B 使Fe3+完全沉淀 C 提高溶液的pH D 除去过量的氧化剂
④从滤液经过结晶得到氯化铜晶体的方法是_________。
【答案】SiO2 NaOH 取少量溶液于试管中,滴入几滴KSCN溶液,观察溶液颜色,如果溶液颜色变为血红色,说明溶液中含有Fe3+,否则不含Fe3+ C B BC 蒸发浓缩、冷却结晶、过滤
【解析】
(1)铝土矿中加入过量盐酸,Al2O3、Fe2O3能够溶于盐酸,SiO2不溶,过滤得到沉淀A为SiO2,滤液甲中加入过量NaOH溶液过滤后得到沉淀B和滤液乙,滤液甲中的溶质为氯化铝和氯化铁、HCl,因此沉淀B为Fe(OH)3,滤液乙中含有NaAlO2和NaOH、NaCl,向滤液乙中通入过量二氧化碳得到氢氧化铝沉淀和碳酸氢钠溶液,据此分析解答;
(2)向含少量铁的氧化铜固体中加入盐酸,盐酸和铁、氧化铜反应,发生的离子反应方程式为:Fe+2H+=Fe2++H2↑;CuO+2H+=Cu2++H2O,加入氧化剂A的目的是把亚铁离子氧化;加入试剂B的目的是调节pH使铁离子生成氢氧化铁沉淀,过滤除去沉淀,对滤液进行蒸发浓缩、冷却结晶、过滤得到氯化铜晶体,据此分析解答。
(1)①由以上分析可知A为SiO2;滤液甲中含有Al3+、Fe3+、过量的H+等,应加入氢氧化钠,除去铁离子,将铝离子转化为AlO2-,故答案为:SiO2;NaOH溶液;
②铁离子与KSCN反应,溶液变红色,检验溶液中存在Fe3+的操作方法为取少量溶液于试管中,滴入几滴KSCN溶液,观察溶液颜色。如果溶液颜色变为血红色,说明溶液中含有Fe3+,否则不含Fe3+,故答案为:取少量溶液于试管中,滴入几滴KSCN溶液,观察溶液颜色。如果溶液颜色变为血红色,说明溶液中含有Fe3+,否则不含Fe3+;
(2)向固体中加入盐酸,盐酸和铁、氧化铜反应,发生的离子反应方程式为:Fe+2H+=Fe2++H2↑;CuO+2H+=Cu2++H2O,加入氧化剂A的目的是把亚铁离子氧化,根据除杂原则,不能引入新的杂质;加入试剂B的目的是调节pH使铁离子生成氢氧化铁沉淀,过滤除去沉淀,对滤液进行蒸发浓缩、冷却结晶、过滤得到氯化铜晶体。
①根据题意,加入的氧化剂A可把Fe2+氧化为Fe3+,而没有增加新杂质,所以A为Cl2,故选C;
②试剂B的目的是调节pH使铁离子生成氢氧化铁沉淀,为了得到较纯的产品,试剂B可选用CuO或Cu2(OH)2CO3,A、C均会引入杂质离子,故选B;
③溶液酸性较强,铁离子不沉淀,为使铁离子沉淀完全,需要提高溶液的pH,故选BC;
④从滤液中得到氯化铜晶体,首先要加热蒸发浓缩,冷却结晶后,再将沉淀过滤出来,经过洗涤、干燥即可,故答案为: 蒸发浓缩、冷却结晶、过滤。

 阅读快车系列答案
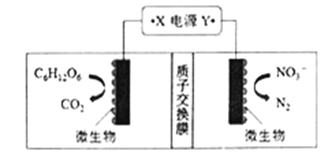
阅读快车系列答案【题目】(1)世界水产养殖协会介绍了一种利用电化学原理净化鱼池中水质的方法,其装置如图所示。请写出阴极的电极反应式 _________________________。
(2)甲醇可利用水煤气合成:CO(g)+2H2(g) ![]() CH3OH(g) △H<0. 一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变温度或压强时,平衡后CH3OH的体积分数 φCH3OH)变化趋势如图所示。下列说法正确的是___________。
CH3OH(g) △H<0. 一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变温度或压强时,平衡后CH3OH的体积分数 φCH3OH)变化趋势如图所示。下列说法正确的是___________。
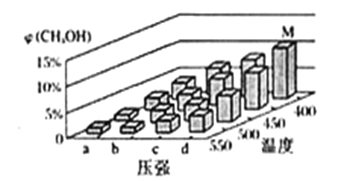
A.状态M,平衡时的CO转化率为10%
B.图中压强的大小关系是a<b<c<d
C.恒温恒压时,在原平衡体系中再充入适量甲醇,重新平衡后体系中甲醇的体积分数不变
D.当体系中 n(CO)/n(H2)的值不随时间变化时,体系达到平衡
(3)二氧化硫和碘水会发生如下二步反应:
反应 | 活化能 | |
第一步 | SO2+I2+2H2O | 9.2kJ·mo1-1 |
第二步 | I2+ I— | 23.5kJ·mo1-1 |
一定条件下,1mol SO2分别加入到体积相同、浓度不同的碘水中,体系达到平衡后,H+、I3—、SO42—的物质的量随n(I2)/n(SO2)的变化曲线如图 (忽略反应前后的体积变化)。

①有人认为X点的I—浓度小于Y点,你认为该观点是否正确________,原因是_________________。
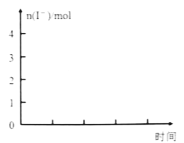
②当n(I2)/n(SO2)=4时,请在下图画出体系中n (I—)反应时间的变化曲线。________
③化学兴趣小组拟采用下述方法来测定I2+I—![]() I3—的平衡常数(室温条件下进行,实验中溶液体积变化忽略不计):
I3—的平衡常数(室温条件下进行,实验中溶液体积变化忽略不计):
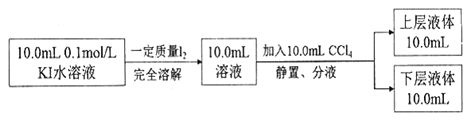
已知:I—和I3 —不溶于CCl4;:一定温度下,碘单质在四氯化碳和水混合液体中,碘单质的浓度比值 ![]() 即是一个常数(用Kd表示,称为分配系数),室温条件下 Kd=85。实验测得上层溶液中c(I3 —)=0.049mol/L,下层液体中c(I2)=0.085mol·L-1。结合上述数据,计算室温条件下I2+ I—
即是一个常数(用Kd表示,称为分配系数),室温条件下 Kd=85。实验测得上层溶液中c(I3 —)=0.049mol/L,下层液体中c(I2)=0.085mol·L-1。结合上述数据,计算室温条件下I2+ I—![]() I3—的平衡常数K=_______(保留三位有效数字)。
I3—的平衡常数K=_______(保留三位有效数字)。
【题目】下表是关于有机物A、B、C的信息:
A | B | C |
①它的产量可衡量一个国家石油化工发展水平; ②能使溴的四氯化碳溶液褪色; ③可用于果实催熟. | ①C、H两种元素组成 ②分子球棍模型为 | ①分子键线式为 ②相对分子质量为68 |
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称为_______________;
(2)A在一定条件下,与水反应制乙醇的化学方程式:____________________;反应类型是______。
(3)B具有的性质是_____________________(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤任何条件下均不与氢气反应
⑥一定条件下,能与CH2=CH2反应制苯乙烷 ⑦与溴水混合后液体分层且上层呈橙红色
(4)写出B的最简单同系物制TNT的化学方程式 _____________________;反应类型是________。
(5)C是天然橡胶的单体,写出天然高分子橡胶的结构简式________________________________。

