题目内容
(2011?顺义区二模)某学习小组探究氨的还原性及检验产物的性质,按下图装置进行实验(夹持仪器已略去).将B处的Cr2O3加热至红热,再鼓入空气,已知:无水CaCl2可吸收氨气和水 回答下列问题: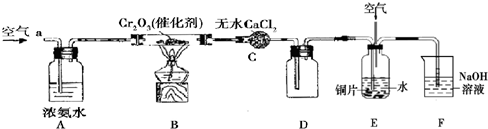
(1)B中发生反应的化学方程式是
(2)证明氨气发生了催化氧化的现象是
(3)E中铜发生反应的离子方程式是
(4)E中缓缓通入空气的目的是
(5)氨作为燃料电池燃气时发生的总反应为4NH3+3O2=2N2+6H2O,该燃料电池以KOH溶液为电解质溶液,负极反应式是

(1)B中发生反应的化学方程式是
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.
| ||
| △ |
(2)证明氨气发生了催化氧化的现象是
D中广口瓶中有红棕色气体
D中广口瓶中有红棕色气体
,发生反应的方程式是2NO+O2=2NO2
2NO+O2=2NO2
.(3)E中铜发生反应的离子方程式是
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
.(4)E中缓缓通入空气的目的是
使NO充分转化为NO2,避免空气污染
使NO充分转化为NO2,避免空气污染
.(5)氨作为燃料电池燃气时发生的总反应为4NH3+3O2=2N2+6H2O,该燃料电池以KOH溶液为电解质溶液,负极反应式是
2NH3-6e-+6OH-=N2+6H2O
2NH3-6e-+6OH-=N2+6H2O
.分析:(1)氨的催化氧化产物是一氧化氮和水,据此来书写反应方程式;
(2)氨气发生了催化氧化的产物一氧化氮极易和氧气化合为二氧化氮;
(3)二氧化氮和水反应会获得硝酸,铜和硝酸反应生成硝酸铜、一氧化氮和水;
(4)为了保证一氧化氮充分转化为NO2,所通空气要缓慢;
(5)燃料电池中,负极是燃料发生失电子的氧化反应.
(2)氨气发生了催化氧化的产物一氧化氮极易和氧气化合为二氧化氮;
(3)二氧化氮和水反应会获得硝酸,铜和硝酸反应生成硝酸铜、一氧化氮和水;
(4)为了保证一氧化氮充分转化为NO2,所通空气要缓慢;
(5)燃料电池中,负极是燃料发生失电子的氧化反应.
解答:解:(1)B中发生的反应是氨的催化氧化反应,原理方程式为:4NH3+5O2
4NO+6H2O,
故答案为:4NH3+5O2
4NO+6H2O;
(2)氨气发生了催化氧化的产物一氧化氮极易和氧气化合为二氧化氮,即2NO+O2=2NO2 所以D中广口瓶中有红棕色气体产生,故答案为:D中广口瓶中有红棕色气体;2NO+O2=2NO2;
(3)在E中,生成的二氧化氮和水反应会获得硝酸,金属铜会和硝酸反应,实质是:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(4)为了使使NO充分转化为NO2,避免空气污染,在E中要缓缓通入空气,
故答案为:使NO充分转化为NO2,避免空气污染;
(5)燃料电池中,负极是燃料发生失电子的氧化反应,所以氨作为燃料电池燃气时,负极上是氨气失电子的过程,
即2NH3-6e-+6OH-=N2+6H2O,故答案为:2NH3-6e-+6OH-=N2+6H2O.
| ||
| △ |
故答案为:4NH3+5O2
| ||
| △ |
(2)氨气发生了催化氧化的产物一氧化氮极易和氧气化合为二氧化氮,即2NO+O2=2NO2 所以D中广口瓶中有红棕色气体产生,故答案为:D中广口瓶中有红棕色气体;2NO+O2=2NO2;
(3)在E中,生成的二氧化氮和水反应会获得硝酸,金属铜会和硝酸反应,实质是:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(4)为了使使NO充分转化为NO2,避免空气污染,在E中要缓缓通入空气,
故答案为:使NO充分转化为NO2,避免空气污染;
(5)燃料电池中,负极是燃料发生失电子的氧化反应,所以氨作为燃料电池燃气时,负极上是氨气失电子的过程,
即2NH3-6e-+6OH-=N2+6H2O,故答案为:2NH3-6e-+6OH-=N2+6H2O.
点评:本题是一道实验探究题目,考查学生氨气的制取和性质,要求学生具有分析和解决问题的能力,难度不大.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
