题目内容
8.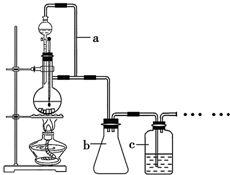 某同学查阅资料后设计了一条1-丁醇的合成路线:
某同学查阅资料后设计了一条1-丁醇的合成路线:CH3CH=CH2+CO+H2$\stackrel{一定条件}{→}$CH3CH2CH2CHO$→_{Ni△}^{H_{2}}$CH3CH2CH2CH2OH.
其中CO的制备方法:HCOOH$→_{△}^{浓硫酸}$CO↑+H2O.
请填写下列空白:
(1)利用以上装置制备CO、丙烯等原料气体,装置中a的作用导管a平衡分液漏斗内压强,使分液漏斗内的液体顺利滴下;b的作用安全瓶b防止实验过程中c中液体倒吸入反应装置.
(2)制丙烯时,伴随的副反应还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是④⑤①③②(或④⑤①⑤③②)(填序号).
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(3)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是D.
A.高温、常压、催化剂 B.适当的温度、常压、催化剂
C.低温、高压、催化剂 D.适当的温度、高压、催化剂
(4)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品,为纯化1-丁醇,该小组查阅文献得知:①R-CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓;
②沸点:乙醚34℃,1-丁醇118℃,并设计出如下提纯路线:
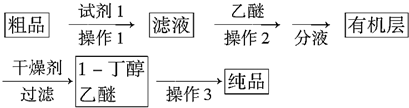
试剂1为饱和NaHSO3溶液,操作2为萃取,操作3为蒸馏.
分析 CO的制备方法:HCOOH$→_{△}^{浓硫酸}$CO↑+H2O,在题给装置中,导管a平衡分液漏斗内压强,使分液漏斗内的液体浓硫酸顺利滴下,b主要是起安全瓶的作用,以防止倒吸;c为除去CO中的酸性气体,选用NaOH溶液,还需用d装置除去CO中的H2O,试剂选用浓硫酸;
(1)为了使产生的气体能顺利的从发生装置中排出,就必需保持压强一致,因此a的作用是保持恒压;
(2)用无水硫酸铜检验水,用品红检验二氧化硫,并用酸性高锰酸钾除去二氧化硫,用石灰水检验二氧化碳,最后用酸性高锰酸钾检验乙烯;
(3)题给合成正丁醛的反应为气体体积减小的放热反应,为增大反应速率和提高原料气的转化率;
(4)根据题中物质提纯的流程,粗品中含有正丁醛,利用信息①可知饱和NaHSO3溶液形成沉淀,然后通过过滤即可除去;加入乙醚的目的是萃取溶液中的1-丁醇,1-丁醇和乙醚的沸点相差很大,因此可以利用蒸馏将其分离开.
解答 解:(1)CO的制备方法:HCOOH$→_{△}^{浓硫酸}$CO↑+H2O,反应有气体产生,为了平衡分液漏斗内压强使用导管a,使分液漏斗内的液体浓硫酸顺利滴下,b主要是起安全瓶的作用,防止实验过程中c中液体倒吸入反应装置,
故答案为:导管a平衡分液漏斗内压强,使分液漏斗内的液体顺利滴下.安全瓶b防止实验过程中c中液体倒吸入反应装置;
(2)2-丙醇通过消去反应即到达丙烯,方程式为(CH3)2CHOH$→_{△}^{浓硫酸}$CH2=CHCH3↑+H2O,检验丙烯可以用酸性KMnO4溶液,检验SO2可以用酸性KMnO4溶液褪色、品红溶液或石灰水,检验CO2可以石灰水,检验水蒸气可以无水CuSO4,所以在检验这四种气体必需考虑试剂的选择和顺序.只要通过溶液,就会产生水蒸气,因此先检验水蒸气;然后检验SO2并在检验之后除去SO2,除SO2可以用饱和Na2SO3溶液,最后检验CO2和丙烯,因此顺序为④⑤①②③(或④⑤①③②),
故答案为:④⑤①③②(或④⑤①⑤③②);
(3)由于反应是一个体积减小的可逆反应,所以采用高压,有利于增大反应速率和提高原料气的转化率;正向反应是放热反应,虽然低温有利于提高原料气的转化率,但不利于增大反应速率,因此要采用适当的温度;催化剂不能提高原料气的转化率,但有利于增大反应速率,缩短到达平衡所需要的时间,故正确所选项是D,
故答案为:D;
(4)粗品中含有正丁醛,根据所给的信息利用饱和NaHSO3溶液形成沉淀,然后通过过滤即可除去;由于饱和NaHSO3溶液是过量的,所以加入乙醚的目的是萃取溶液中的1-丁醇;因为1-丁醇和乙醚的沸点相差很大,因此可以利用蒸馏将其分离开,
故答案为:饱和NaHSO3溶液;萃取;蒸馏.
点评 本题考查了气体的制备、有机物的分离、提纯方法、醇的性质以及对基础知识和基本操作的考查,答题时注意把握基础知识和基本实验操作的灵活运用,题目难度中等.

| A. | 原NaOH溶液的浓度是1.00mol/L,所得固体是Na2CO3 | |
| B. | 原NaOH溶液的浓度是0.500mol/L,所得固体是Na2CO3和NaHCO3 | |
| C. | 原NaOH溶液的浓度是1.00mol/L,所得固体是Na2CO3和NaOH | |
| D. | 原NaOH溶液的浓度是0.90mol/L,所得固体是Na2CO3和NaHCO3 |
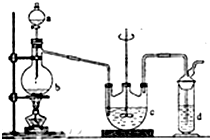 硫代硫酸钠(Na2S2O3)俗名大苏打,可用做分析试剂.它易溶于水,难溶于酒精,受热、遇酸易分解.工业上可用硫化碱法制备,反应原理:
硫代硫酸钠(Na2S2O3)俗名大苏打,可用做分析试剂.它易溶于水,难溶于酒精,受热、遇酸易分解.工业上可用硫化碱法制备,反应原理:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2,实验室模拟该工业过程的装置如图所示,回答下列问题:
(1)b中反应的离子方程式为SO32-+2H+=H2O+SO2↑或HSO3-+H+=SO2↑+H2O,c中试剂为硫化钠和碳酸钠的混合溶液.
(2)反应开始后,c中先有浑浊产生,后又变为澄清,此浑浊物是S.
(3)控制b中的溶液的pH接近7,停止通入SO2.若未控制好pH<7,会影响产率,原因是(用离子方程式表示)S2O32-+2H+=S↓+H2O+SO2↑
(4)停止通入SO2后,将c中的溶液抽入d中,d中的试剂为NaOH溶液.
(5)将d所得液溶转移到蒸发皿中,水浴加热浓缩,冷却结晶、过滤、洗涤,洗涤晶体所用的试剂为(填化学式)C2H5OH.
(6)实验中要控制SO2生成速率,可采取的措施有控制反应温度、调节酸的滴加速度或调节酸的浓度等;(写出一条)
(7)为检验制得的产品的纯度,该实验小组称取5.0克的产品配制成250mL硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入25mL0.01mol/LKIO3溶液,并加入过量的KI酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,当蓝色褪去且半分钟不变色时达到滴定终点.实验数据如下表:
| 实验序号 | 1 | 2 | 3 |
| Na2S2O3溶液体积(mL) | 19.98 | 20.02 | 21.18 |
A.滴定管未用Na2S2O3溶液润洗
B.滴定终点时仰视读数
C.锥形瓶用蒸馏水润洗
D.滴定管尖嘴处滴定前无气泡,滴定终点发现气泡.
(1)某温度下,Ksp(FeS)=8.1×10-17,FeS饱和溶液中c(H+)与c(S2-)之间存在关系:
c2(H+)•c(S2-)=1.0×10-22,为了使溶液里c(Fe2+)达到1mol•L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的pH约为B(填字母).
A.2 B.3 C.4 D.5
(2)氧化铁红颜料跟某些油料混合,可以制成防锈油漆.以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:

①酸溶过程中Fe2O3发生反应的离子方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;“滤渣A”主要成分的化学式为SiO2.
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓.
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是3.2~3.8.
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
⑤滤液B可以回收的物质有ABD(填序号).
A.Na2SO4 B.Al2(SO4)3 C.Na2SiO3 D.MgSO4.
| A. | 1 种 | B. | 2 种 | C. | 3 种 | D. | 4 种 |
| A. | 氯水用于漂白表现了HClO的强氧化性 | |
| B. | 将一小块金属钠投入稀硫酸铜溶液中会有红色固体析出 | |
| C. | 过氧化钠可用作呼吸面具中的供氧剂 | |
| D. | 等质量的Na2CO3和NaHCO3两种固体,分别与过量盐酸反应,NaHCO3生成CO2的质量比较多 |
 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示: