题目内容
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是( )
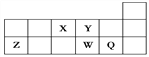
A. 原子半径的大小顺序为:rX>rY>rZ>rW>rQ
B. 元素W的最高价氧化物对应的水化物酸性比Q的强
C. 离子Y2-和Z3+的核外电子数和电子层数都不相同
D. 元素X与元素Z的最高正化合价之和的数值等于8
【答案】D
【解析】由元素在短周期中的位置可知,X为氮元素、Y为氧元素、Z为Al元素、W为硫元素、Q为Cl元素。A.同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径rZ>rW>rQ>rX>rY>,故A错误;B.非金属性Cl>S,故酸性HClO4>H2SO4,故B错误;C.O2-、Al3+核外电子数都是10、都有2个电子层,故C错误;D.元素X的最高正价为+5,元素Z的最高正化合价为+3,二者最高正化合价之和等于8,故D正确;故选D。

练习册系列答案
相关题目
【题目】某合金与铁的物理性质的比较如下表所示:
熔点/℃ | 密度/ g·cm-3 | 硬度(金刚石为10) | 导电性(银为100) | ||
某合金 | 2 500 | 3.00 | 7.4 | 2.3 | |
铁 | 1 535 | 7.86 | 4.5 | 17 | |
还知该合金耐腐蚀,强度大,从以上性能看,该合金不适合作( )
A. 导线 B. 门窗框 C. 炉具 D. 飞机外壳