题目内容
【题目】天然气和可燃冰(mCH4·nH2O)既是高效洁净的能源,也是重要的化工原料。
(1)可燃冰(mCH4·nH2O)属于 晶体。
(2)已知25 ℃、101 kPa 时,1 g甲烷完全燃烧生成液态水放出55.64 kJ热量,则该条件下反应CH4(g)+2O2 (g)=CO2 (g)+2H2O (l)的ΔH=
(3)用甲烷空气碱性(KOH溶液)燃料电池作电源,电解CuCl2溶液。装置如图所示:
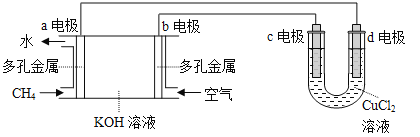
①a电极名称为 。
②c电极的电极反应式为 。
③假设CuCl2溶液足量,当某电极上析出3.2 g 金属Cu时,理论上燃料电池消耗的空气在标准状况下的体积是 L(空气中O2体积分数约为20%)。
【答案】(1)分子(1分)(2)-890.24 kJ/mol (3)①负极(1分) ②2Cl--2e- = Cl2↑ ③2.8
【解析】
试题分析:(1)可燃冰的熔沸点较低,属于分子晶体。
(2)1 g甲烷完全燃烧生成液态水放出55.64 kJ热量,则1mol甲烷完全燃烧生成液态水放出热量为55.64kJ×16=890.24,则该条件下反应的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)的ΔH=-890.24kJ/mol。
(3)①甲烷、空气燃料电池中,甲烷在负极失电子发生氧化反应,则a电极是负极,氧气在正极得电子发生还原反应,b电极是正极;
②根据上述分析,b电极是正极,则c电极与电源的正极相连,c电极是阳极,溶液中的氯离子在阳极放电生成氯气,电极反应为2Cl--2e-=Cl2↑;
③根据电极反应,阴极:Cu2++2e-=Cu,正极:O2+4e-+2H2O=4OH-,因为各个电极放电量相等,则Cu与氧气的关系式为2Cu~O2,3.2g铜的物质的量为0.05mol,则需要氧气0.025mol,空气中O2体积分数约为20%,所以通入空气的体积为0.025mol×5×22.4L/mol=2.8L。

 阅读快车系列答案
阅读快车系列答案【题目】研究氮的固定具有重要意义。
(1)雷雨天气中发生自然固氮后,氮元素转化为 而存在于土壤中.处于研究阶段的化学固氮新方法是N2在催化剂表面与水发生如下反应:
2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H K ①
已知:N2(g)+3H2(g)=2NH3(g)△H1=﹣92.4kJmol﹣1 K1 ②
2H2(g)+O2(g)=2H2O(l)△H2=﹣571.6kJmol﹣1 K2 ③
则△H= ;K= (用K1和 K2表示)。
(2)在四个容积为2L的密闭容器中,分别充入1mol N2、3mol H2O,在催化剂条件下进行反应①3小时,实验数据见下表:
序号 | 第一组 | 第二组 | 第三组 | 第四组 | ||||||||||
t/℃ | 30 | 40 | 50 | 80 | ||||||||||
NH3生成量/(10﹣6mol) | 4.8 | 5.9 | 6.0 | 2.0 | ||||||||||
下列能说明反应①达到平衡状态的是 (填字母)。K]
a.NH3和O2的物质的量之比为4:3
b.反应混合物中各组份的质量分数不变
c.单位时间内每消耗1molN2的同时生成2molNH3
d.容器内气体密度不变
若第三组反应3h后已达平衡,第三组N2的转化率为 ;与前三组相比,第四组反应中NH3生成量最小的原因可能是 。