题目内容
25℃时,浓度均为1 mol/L的AX、BX、AY、BY四种正盐溶液,AX溶液的pH=7且溶液中c(X-)=1 mol/L,BX溶液的pH=4,BY溶液的pH=6。下列说法正确的是
| A.AY溶液的pH小于7 |
| B.AY溶液的pH小于BY溶液的pH |
| C.稀释相同倍数,BX溶液的pH变化小于BY溶液 |
| D.电离平衡常数K(BOH)小于K(HY) |
D
解析

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列反应不属于水解反应或水解方程式不正确的是
①HCl+H2O H3O++Cl-
H3O++Cl-
②AlCl3+3H2O=Al(OH)3+3HCl
③Na2CO3+2H2O H2CO3+2NaOH
H2CO3+2NaOH
④碳酸氢钠溶液:HCO3-+H2O=CO32-+H3O+
⑤NH4Cl溶于D2O中:NH4++D2O NH3·D2O+H+
NH3·D2O+H+
| A.①②③④ | B.①②③ |
| C.②③⑤ | D.全部 |
以水为溶剂进行中和滴定的原理是:H3O++OH-=2H2O。已知液态SO2和纯水的导电性相近,因为液态SO2也会发生自离解:SO2(l)+SO2(l)  SO32-+SO2+。若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是( )
SO32-+SO2+。若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是( )
| A.该滴定反应可以表示为:SO32-+SO2+=2SO2 |
| B.在一定温度下,液态SO2中c(SO32-)与c(SO2+)的乘积是一个常数 |
| C.自离解的存在,说明SO2是离子化合物 |
| D.可通过导电能力变化来判断是否到达滴定终点 |
下列有关电解质溶液的说法正确的是
| A.在蒸馏水中滴加浓H2SO4,KW不变 |
| B.CaCO3难溶于稀硫酸,也难溶于醋酸 |
| C.在Na2S稀溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-) |
| D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
向10 mL 0.1 mol·L-1Na2CO3溶液中逐滴滴加V mL 0.1 mol·L-1HCl溶液,下列有关滴定过程中粒子浓度关系正确的是
A.当V=0时,c(OH-)=c(H+)+c(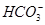 )+c(H2CO3) )+c(H2CO3) |
B.当V=5时,c(Na+)+c(H+)=2c( )+c( )+c(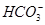 )+c(OH-) )+c(OH-) |
C.当V=10时,c(Cl-)=c( )+c( )+c(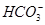 )+c(H2CO3) )+c(H2CO3) |
D.当V=15时,c(Na+)=c(Cl-)>c(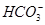 )>c(OH-)>c(H+) )>c(OH-)>c(H+) |
下列液体均处于25 ℃,有关叙述正确的是
| A.某物质溶液的pH>7,则该物质一定是碱或强碱弱酸盐 |
| B.pH=6.5的牛奶中c(H+)是pH=4.5的H2SO4溶液中c(H+)的100倍 |
| C.pH=3的醋酸与pH=11的NaOH溶液等体积混合后溶液中: c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D.AgCl在等浓度的CaCl2溶液和NaCl溶液中的溶解度相同 |
下列有关电解质溶液的说法正确的是
| A.在蒸馏水中滴加浓H2SO4,Kw不变 |
B.CH3COOH溶液加水稀释后,溶液中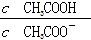 的值减小 的值减小 |
C.Na2CO3溶液中加入少量Ca(OH)2固体, 水解程度减小,溶液的pH减小 水解程度减小,溶液的pH减小 |
| D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
关于10 mL 0.1 mol·L-1的NH3·H2O溶液,下列说法正确的是
| A.25 ℃时,若溶液的pH=11,则Kb(NH3·H2O)=1×10-6 mol·L-1 |
B.向溶液中加入少量CH3COONa固体,溶液中的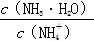 值变小 值变小 |
C.向溶液中加入10 mL 0.1 mol·L-1 HCl,所得溶液中离子浓度大小顺序为c(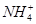 )>c(Cl-)>c(H+)>c(OH-) )>c(Cl-)>c(H+)>c(OH-) |
D.向溶液中加入5 mL 0.1 mol·L-1 HCl,所得溶液中离子的浓度一定符合:c(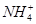 )+c(H+)=c(Cl-)+c(OH-) )+c(H+)=c(Cl-)+c(OH-) |
已知,常温下,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17,下列叙述中,正确的是( )
| A.常温下,AgCl在饱和NaCl溶液中的Ksp比在纯水中的Ksp小 |
| B.向AgCl的悬浊液中加入KI溶液,沉淀由白色转化为黄色 |
| C.将0.001 mol·L-1的AgNO3溶液滴入KCl和KI的混合溶液中,一定先产生AgI沉淀 |
| D.向AgCl的饱和溶液中加入NaCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl-) |