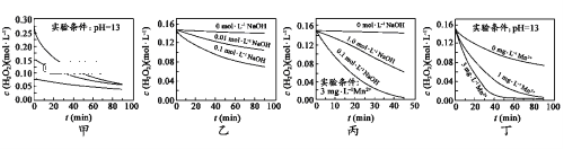
题目内容
【题目】某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu 64)。
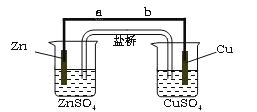
按照实验步骤依次回答下列问题:
⑴导线中电子流向为 (用a、b 表示)。
⑵写出装置中锌电极上的电极反应式: ;
⑶若装置中铜电极的质量增加0.64g,则导线中转移的电子数目为 ;
(不许用“NA”表示)
(4)装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+,Cl-的移动方向描述正确的是 。
A. 盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B. 盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C. 盐桥中的K+、Cl-都向右侧烧杯移动
D. 盐桥中的K+、Cl-几乎都不移动
⑸若ZnSO4溶液中含有杂质Cu2+,会加速Zn电极的腐蚀、还可能导致电流在较短时间内衰减。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
A. NaOH B. Zn C. Fe D. H2SO4
【答案】(1)Zn﹣2e﹣→Zn2+(2)0.02NA(3)B (4)B
【解析】
图为原电池装置,金属性锌强于铜,Zn为负极,Cu为正极。则
(1)电子由负极流向正极,则电子流向为由a到b(或a→b);
(2)负极Zn失去电子,电极反应式为Zn-2e-=Zn2+;
(3)铜电极发生Cu2++2e-=Cu,增加0.64g,n(Cu)=0.64g÷64g/mol=0.01mol,转移0.02mol电子,转移电子数目为0.02mol×6.02×1023/mol=1.204×1022;
(4)盐桥中的K+、Cl-的移动方向为阳离子向正极移动,阴离子向负极移动,右侧为负极,左侧为正极,选项B正确,答案选B;
(5)要除去Cu2+,可促进其水解生成沉淀,注意不引入新的杂质,AC会引入杂质,D抑制水解,只有B符合,答案选B。

 名校课堂系列答案
名校课堂系列答案【题目】根据题意完成下列问题:
(1)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
已知:2H2 (g) + O2 (g) = 2H2O (g) ΔH=-484 kJ/mol,写出CO完全燃烧生成CO2的热化学方程式:_______________________________________。
(2)随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NO x、SO2、CO等大气污染气体的处理具有重要意义。用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g)。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol·L-1 时间/min | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
50 | 0.032 | 0.034 | 0.017 |
①则从反应开始到20min时,以NO表示的平均反应速率= ________,该温度下该反应的平衡常数K=____(保留两位小数)
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是_____(写一条即可)。
③下列描述中能说明上述反应已达平衡的是__________;
A、容器内气体的平均摩尔质量保持不变
B、2v(NO)正=v(N2)逆
C、容器中气体的压强保持不变
D、单位时间内生成nmolCO2的同时生成2nmolNO
(3)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-, 而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为_______________
(4)有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。
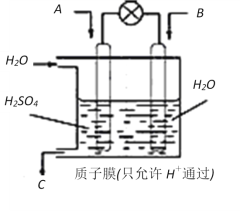
若A为SO2,B为O2,C为H2SO4,则负极反应式为_______________________________,电池总反应式为________________________。