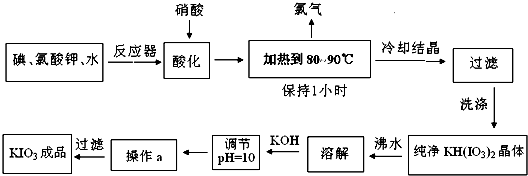
��Ŀ����
��10�֣��������һ�ְ�ɫ�ᾧ��ĩ������ζ�������������µ������һ�ֽ�ǿ����������������ᡢ��������Ȼ�ԭ���������ã�����ԭΪ���ʵ⣬�ڼ��Խ����У�������ܱ��������������ε�����Ϊ�ߵ���ء�������ڳ������ȶ���������560 �濪ʼ�ֽ⡣��ҵ��������ص���������ͼ��ʾ��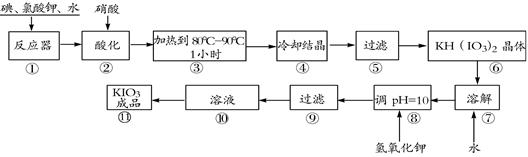
��1���ڷ�Ӧ���з����ķ�ӦI2��KClO3��H2O��KH(IO3)2��KCl��Cl2��δ��ƽ�����������ֻ�ԭ�������õ�����Ŀ��ͬ����д������ƽ�ĸ÷�Ӧ�Ļ�ѧ����ʽ�� ��
��2��������У������������HI����ԭ������� ��
��3�������Ҫ������Һ��1Сʱ����ȫ�ų��������ų�������ԭ��Ϊ ��
��4�������±�����ص��ܽ�ȣ�����ϵõ�����ؾ��壬Ӧ���õķ����� ��
| �¶�/�� | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3(g/100gˮ) | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
��1��6I2��11KClO3��3H2O��6KH(IO3)2��5KCl��3Cl2 ��2�֣�
��2��HI���л�ԭ�ԣ��ܽ������ɵĵ�����ػ�ԭ ��2�֣�
��3���ڢಽ��Ҫ����Һ��Ϊ���Դ�ʱ������Cl2���ὫKIO3������KIO4 ��2�֣�
��4�������ᾧ ��2�֣�
��5��2H+ -2e - = H2�� ��2�֣�
������1���������ֻ�ԭ�������õ�����Ŀ��ͬ�� n(KCl)��(5�D(-1))=n(Cl2)��(5-0)��2, n(KCl):n(Cl2)=5:3,6I2��11KClO3��3H2O��6KH(IO3)2��5KCl��3Cl2
��2��HI���л�ԭ�ԣ��ܽ������ɵĵ�����ػ�ԭ
��3���ڢಽ��Ҫ����Һ��Ϊ���Դ�ʱ������Cl2���ὫKIO3������KIO4
��4��KIO3���ܽ�����¶�Ӱ�첻���������ᾧ��
��5��2H+ -2e - = H2��

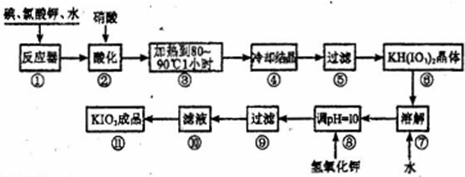

 �õ�����ؾ��壬�㽨��ķ�����
�õ�����ؾ��壬�㽨��ķ�����