题目内容
【题目】如图所示的过程是目前直接利用太阳能的研究热点。人们把通过人工光化学手段合成燃料的过程叫做人工光合作用。
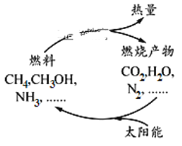
(1)在上图构想的物质和能量循环中太阳能最终转化为____________能。
(2)人工光合作用的途径之一就是在催化剂和光照条件下,将CO2和H2O转化为CH3OH,该反应的化学方程式为:2CO2(g)+4H2O(g)![]() 2CH3OH(g)+3O2(g)。
2CH3OH(g)+3O2(g)。
一定条件下,在2 L密闭容器中进行上述反应,测得n(CH3OH)随时间的变化如表所示:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
n(CH3OH)/mol | 0.000 | 0.040 | 0.070 | 0.090 | 0.100 | 0.100 | 0.100 |
①用CH3OH表示0~3 min内该反应的平均反应速率为______________________。
②能说明该反应已达到平衡状态的是_______________。
a.v正(H2O)=2v逆(CO2) b.n(CH3OH):n(O2)=2:3
c.容器内密度保持不变 d.容器内压强保持不变
(3)我国科学家用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。
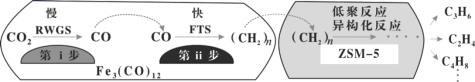
催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如表。

①欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加____________助剂效果最好;
②加入助剂能提高单位时间内乙烯产量的根本原因是____________。
(4)用人工光合作用得到的甲醇、氧气和稀硫酸制作电池,则甲醇应通入该电池的____极(填“正”或“负”),溶液中的H+流向该电池的____极(填“正”或“负”)通入氧气的一极的电极反应式为_______________。
【答案】热 0.015 mol/(Lmin) ad K 加快乙烯生成速率,而对其他副反应几乎无影响 负 正 O2+4H++4e-=2H2O
【解析】
(1)光合作用下生成燃料,燃料燃烧释放出能量;
(2)①根据表中数据可知,5 min后达到平衡状态,甲醇的物质的量为0.100 mol,利用3 min时甲醇的物质的量,结合容器的容积计算其物质的量的浓度,再根据v=![]() 计算用甲醇表示0~3 min内该反应的平均反应速率;
计算用甲醇表示0~3 min内该反应的平均反应速率;
②可逆反应达到平衡时,正、逆反应速率相等,各物质的浓度、含量不变,甲醇判断;
(3)①结合图表数据分析三种助剂对CO2转化率和乙烯在产物中的百分比分析;
②根据助剂起催化作用,结合催化剂在反应中的作用分析;
(4)该原电池中,通入燃料甲醇的电极是负极、通入氧气的电极是正极;甲醇失去电子生成二氧化碳气体,氧气得到电子与溶液中H+结合形成水;溶液中阳离子向正极定向移动,阴离子向负极定向移动。
(1)由据图可知,太阳能首先转化为化学能,然后再由化学能转化为热能,故太阳能最终能量转化形式为热能;
(2)①根据表中数据可知,3 min时甲醇的物质的量为0.09 mol,由于容器的容积是2 L,反应时间是3 min,故用甲醇表示的反应速率v(CH3OH)=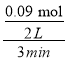 =0.015 mol/(Lmin);
=0.015 mol/(Lmin);
②a.v正(H2O)=2v逆(CO2) 可说明正、逆反应速率相等,达到平衡状态,a正确;
b.在任何条件下都存在关系n(CH3OH):n(O2)=2:3,因此无法判断各组分的浓度是否继续变化,则无法判断是否达到平衡状态,b错误;
c.因气体的体积以及质量不变,则容器内密度保持不变,不能用于判断是否达到平衡状态,c错误;
d.反应前后气体的体积不等,容器内压强为变量,但容器内压强保持不变,可说明达到平衡状态,d正确;
故合理选项是ad;
(3)①结合图表数据分析可知加钠时CO2转化率最大,但乙烯在产物中百分比太低,副产物过多,加铜时乙烯在产物中的百分比最大,但CO2转化率却太低,综合考虑加K时转化率不算低,同时乙烯在产物中的百分比较高。故欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加K助剂效果最好;
②助剂本身也起催化作用,而催化剂在反应过程中可以降低反应的活化能,从而加快反应速率,因此助剂可以起到降低生成乙烯的反应所需要的活化能,加快乙烯生成速率,而对其他副反应几乎无影响;
(4)在反应中甲醇被氧化,故通入甲醇的电极应为电池的负极,正极上氧气得到电子发生还原反应,则通入氧气的一极为正极,氧气被还原生成水,正极的电极反应式为:O2+4H++4e-=2H2O。根据同种电荷相互排斥,异种电荷相互吸引的原则,溶液中的H+向负电荷较高的正极定向移动。

 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案【题目】下列表格中的各种情况,可以用右图的曲线表示的是 ( )
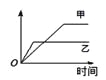
反 应 | 纵坐标 | 甲 | 乙 | |
A | 相同质量的氨,在同一容器中 | 氨气的转化率 | 500℃ | 400℃ |
B | 等质量钾、钠分别与足量水反应 | H2质量 | 钠 | 钾 |
C | 在体积可变的恒压容器中,体积比1︰3的N2、H2, | 氨气的浓度 | 活性高的催化剂 | 活性一般的催化剂 |
D | 2 molSO2和1 molO2,在相同温度下2SO2+ O2 | SO3物质的量 | 2个大气压 | 10个大气压 |
A. AB. BC. CD. D
【题目】电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为____________。
②下列方法中,可以使醋酸溶液中CH3COOH电离程度增大的是_______(填字母序号)。
a 滴加少量浓盐酸 b 微热溶液
c 加水稀释 d 加入少量醋酸钠晶体
(2)用0.1 mol·L-1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
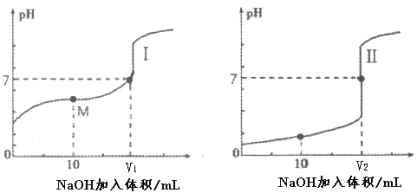
①滴定醋酸的曲线是___________(填“I”或“Ⅱ”)。
②滴定开始前,0.1 mol·L-1 NaOH、0.1 mol·L-1的盐酸和0.1 mol·L-1醋酸三种溶液中由水电离出的c(H+)最大的是_______溶液。
③图I中,V=10时,溶液中的c(H+)_________c(OH-) (填“>”、“=”或“<”,下同),c(Na+)_________c(CH3COO-)。
(3)下表为某同学所测25℃时,甲、乙两种溶液的pH。
甲 | 乙 | |
pH | 11 | 11 |
溶液 | 氨水 | 氢氧化钠溶液 |
①甲溶液中的c(OH-) =___________mol/L。
②25℃时,等体积的甲、乙两溶液与等浓度的盐酸反应,消耗的盐酸体积:甲_____乙。
③甲、乙溶液均加水稀释10倍后,所得溶液的pH:甲_____乙。
(4)煤炭工业中经常会产生大量SO2,为防止污染环境,常采用吸收法进行处理。以下物质可用于吸收SO2的是____________。
A H2O2 B Na2CO3 C Na2SO3 D Ca(OH)2
(5)下表是几种常见弱酸的电离常数
化学式 | CH3COOH | H2SO3 | HClO | H2CO3 |
电离 常数 | 1.8×10-5 | K1=1.23×10-2 K2=6.6×10-8 | 3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 |
/span>
以下反应对应的离子方程式正确的是___________。
A Na2CO3溶液吸收少量SO2:CO32-+SO2+H2O = SO32-+HCO3-
B 漂白液生效的原理:ClO-+CO2+H2O = HClO+HCO3-
C 次氯酸钠溶液吸收少量SO2:ClO-+SO2+H2O = HClO+SO32-
D 醋酸除水垢中的CaCO3:2CH3COOH+CaCO3 = Ca2++2CH3COO-+H2O+CO2↑