题目内容
【题目】实验室用如图所示的装置制取乙酸乙酯.
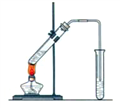
(1)浓硫酸的作用①________;②__________
(2)右边收集试管内装有__________,该溶液的作用是:
①________________②_____________③____________。
(3)实验生成的乙酸乙酯其密度比水____(填“大”或“小”),有____气味.
(4)制取乙酸乙酯的反应方程式是:_______________________________________
(5)若实验中温度过高,使反应温度达到140℃左右时,副反应的主要有机产物是____(填物质的名称).
【答案】 催化剂 吸水剂 饱和碳酸钠溶液 吸收乙酸 溶解乙醇 降低乙酸乙酯在水中的溶解度 小 水果香味  乙醚
乙醚
【解析】(1)乙酸与乙醇发生酯化反应,该反应为可逆反应,需浓硫酸作催化剂,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,故浓硫酸的作用为催化剂、吸水剂,故答案为:催化剂; 吸水剂;
(2)乙醇与乙酸都易挥发,制备的乙酸乙酯含有乙醇与乙酸,通常用饱和碳酸钠溶液吸收乙酸乙酯,中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到酯;故答案为:饱和碳酸钠溶液;吸收除去挥发出来的乙酸和乙醇、降低乙酸乙酯的溶解度;
(3)酯化反应的本质为酸脱羟基,醇脱氢,在A中乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,产物乙酸乙酯在上层,所以密度比水小;乙酸乙酯具有水果香味,故答案为:小;水果香味;
(4)该反应方程式为:CH3COOH+CH3CH2OH![]() CH3COOC2H5+H2O,故答案为:CH3COOH+CH3CH2OH
CH3COOC2H5+H2O,故答案为:CH3COOH+CH3CH2OH![]() CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
(5)若实验中温度过高,使反应温度达到140℃左右时,乙醇分子间脱水生成乙醚,副反应的主要有机产物是乙醚,故答案为:乙醚。

【题目】氮的化合物既是一种资源,也会给环境造成危害。
I.氨气是一种重要的化工原料。
(1)NH3与CO2在120°C,催化剂作用下反应生成尿素:CO2(g)+2NH3(g)![]() (NH2)2CO(s)+H2O(g),ΔH= -x KJ/mol (x>0),其他相关数据如表:
(NH2)2CO(s)+H2O(g),ΔH= -x KJ/mol (x>0),其他相关数据如表:
物质 | NH3(g) | CO2(g) | CO(NH2)2(s) | H2O(g) |
1mol分子中的化学键断裂时需要吸收的能量/KJ | a | b | z | d |
则表中z(用x a b d表示)的大小为________。
(2)120℃时,在2L密闭反应容器中充入3mol CO2与NH3的混合气体,混合气体中NH3的体积分数随反应时间变化关系如图所示,该反应到达平衡时CO2的平均反应速率为_____, 此温度时的平衡常数为_____。

下列能使正反应的化学反应速率加快的措施有___________.
① 及时分离出尿素 ② 升高温度 ③ 向密闭定容容器中再充入CO2 ④ 降低温度
Ⅱ.氮的氧化物会污染环境。目前,硝酸厂尾气治理可采用NH3与于NO在催化剂存在的条件下作用,将污染物转化为无污染的物质。某研究小组拟验证NO能被氨气还原并计算其转化率(已知浓硫酸在常温下不氧化NO气体)。

(l)写出装置⑤中反应的化学方程式_________。
(2)装置①和装置②如下图,仪器A的名称为_____,其中盛放的药品名称为_______。

装置②中,先在试管中加入2-3 粒石灰石,注入适量稀硝酸,反应一段时间后,再塞上带有细铜丝的胶塞进行后续反应,加入石灰石的作用是________。
(3)装置⑥中,小段玻璃管的作用是______;装置⑦的作用是除去NO, NO与FeSO4溶液反应形成棕色[Fe(NO)]SO4溶液,同时装置⑦还用来检验氨气是否除尽,若氨气未除尽,可观察到的实验现象是_________。