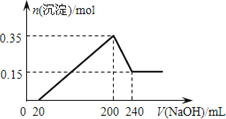
题目内容
【题目】用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一种物质(括号内),溶液能与原来溶液完全一样的是:
A. NaCl(HCl) B.NaOH(NaOH);
C. CuCl2(CuO) D.CuSO4[Cu(OH)2]
【答案】A
【解析】
试题分析:A、电解氯化钠时,阳极产生氯气,阴极产生氢气,所以应加氯化氢让电解质溶液复原,正确;B、电解NaOH时,阳极产生氧气,阴极产生氢气,本质为电解水,所以应加水让电解质溶液复原,错误;C、电解氯化铜时,阳极放氯气,阴极生成金属铜,所以应加氯化铜固体让电解质溶液复原,错误;D、电解硫酸铜时,阳极产生氧气,阴极产生金属铜,所以应加氧化铜让电解质溶液复原,错误.故选C.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目