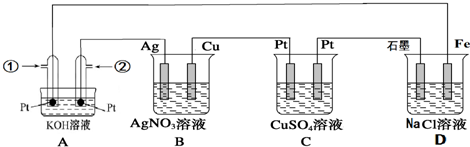
题目内容
4.在给定条件的水溶液中能大量共存的粒子组是( )| A. | 无色透明的溶液中:Fe3+、K+、OH-、NO3- | |
| B. | 能使石蕊试剂变红的溶液:SO42-、Cl-、Cu2+、NH4+ | |
| C. | 强碱性溶液中:K+、Ca2+、Cl-、HCO3- | |
| D. | 强酸性溶液中:Na+、Fe2+、Cl-、ClO- |
分析 A.Fe3+为黄色;
B.能使石蕊试剂变红的溶液,溶液显酸性;
C.强碱性溶液,含大量的氢氧根离子;
D.强酸溶液中离子之间发生氧化还原反应.
解答 解:A.Fe3+为黄色,与无色不符,且Fe3+、OH-结合生成沉淀,不能大量共存,故A错误;
B.能使石蕊试剂变红的溶液,溶液显酸性,该组离子之间不反应,可大量共存,故B正确;
C.强碱性溶液,含大量的氢氧根离子,不能大量存在HCO3-,故C错误;
D.强酸溶液中Fe2+、ClO-发生氧化还原反应,Cl-、ClO-发生氧化还原反应,故D错误;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
14.4gNaOH溶解在10mL水中,稀释至1L后,取出10mL其物质的量浓度是( )
| A. | 0.1mol/L | B. | 1mol/L | C. | 0.01mol/L | D. | 10mol/L |
15.下列物质中互为同系物的是( )
| A. | CH3-CH3CH3-CH2-CH3 | B. | 白磷、红磷 | ||
| C. | 氕、氚 | D. | 丁烷,异丁烷 |
12.通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一.对下列实验事实的解释正确的是( )
| 现象 | 解释 | |
| A | KI淀粉溶液中通入Cl2,溶液变蓝 | Cl2能与淀粉发生显色反应 |
| B | 浓HNO3在光照条件下变黄 | 浓HNO3不稳定,生成有色产物能溶于浓硝酸 |
| C | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 说明该溶液中含有SO42- |
| D | 铜片放入浓硫酸中,无明显变化 | 说明铜在冷的浓硫酸中发生钝化 |
| A. | A | B. | B | C. | C | D. | D |
16.体积为VmL,密度为dg•cm-3的溶液,含有相对分子质量为M的溶质mg,其物质的量浓度为cmol•L-1,质量分数为w,下列表达式正确的是( )
| A. | c=$\frac{w×1000×d}{M}$ | B. | m=V×d×$\frac{w}{100}$ | C. | w=$\frac{c×M}{1000×d}$% | D. | c=$\frac{1000×m}{V×M}$ |
13.设NA代表阿伏加德罗常数,下列说法不正确的是( )
| A. | 常温常压下,2g氮气所含分子数为NA | |
| B. | 0.5 molNa2SO4溶液中所含Na+数为NA | |
| C. | 标准状况下,22.4LNH3所含原子数为NA | |
| D. | 6.5g锌与足量盐酸反应生成氢气0.1NA |
6.下列有关说法正确的是( )
| A. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| B. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1 mol•L-1 | |
| C. | Na的金属活动性比Mg强,故可用Na与MgCl2溶液反应制Mg | |
| D. | 1molNa2O2固体中含离子总数为3NA |