题目内容
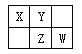
【题目】四种短周期元素在周期表中的相对位置如下图所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
请回答下列问题:
(1)元素Z位于周期表中的位置_____________________。
(2)X、Y、Z三种元素的最高价氧化对应水化物中酸性由强到弱依次为________________(写化学式)。
(3)X和Y形成一种有毒的二元化合物,其相对分子质量在50~60之间,且其分子式中X的质量分数约为46%,该化合物的分子式为__________,该分子中各原子最外层均满足8电子稳定结构,其结构式为 ___________.
(4)写出W的最高价氧化物对应水化物的浓溶液与X在加热条件下反应的化学方程式_____________,
反应中若转移12mol电子,消耗的还原剂质量为______g。
【答案】 第三周期第ⅤA族 HNO3> H3PO4> H2CO3 C2N2或N2C2 N≡C—C≡N C + 2H2SO4(浓)![]() CO2↑+2SO2↑ + 2H2O 36g
CO2↑+2SO2↑ + 2H2O 36g
【解析】首先利用Z的核外电子排布特点判断出Z,进而结合元素在周期表中的位置判断其余元素,最后依据元素周期律和相关物质的性质分析解答。
短周期元素,Z元素原子的核外电子总数是其最外层电子数的3倍,设最外层为x,Z位于第三周期,则(2+8+x)=3x,解得x=5,则Z为P;然后由元素周期表中的位置可知,X为C,Y为N,W为S,则(1)Z为P,原子结构中有3个电子层,最外层电子数为5,则位于元素周期表中的第三周期,第VA族;(2)非金属性S>P>C,非金属性越强,最高价含氧酸的酸性越强,因此酸性强弱顺序是HNO3> H3PO4> H2CO3;(3)C和N形成一种有毒的二元化合物,其相对分子质量在50~60之间,且其分子式中X的质量分数约为46%,所以分子中碳原子个数介于![]() 和
和![]() ,因此该化合物的分子中碳原子个数2,则相对分子质量是
,因此该化合物的分子中碳原子个数2,则相对分子质量是![]() ,所以氮原子个数是
,所以氮原子个数是![]() ,则分子式为C2N2或N2C2,该分子中各原子最外层均满足8电子稳定结构,所以其结构式为N≡C—C≡N;(4)碳和浓硫酸在加热条件下反应的方程式为C + 2H2SO4(浓)
,则分子式为C2N2或N2C2,该分子中各原子最外层均满足8电子稳定结构,所以其结构式为N≡C—C≡N;(4)碳和浓硫酸在加热条件下反应的方程式为C + 2H2SO4(浓)![]() CO2↑+2SO2↑ + 2H2O;碳元素化合价从0价升高到+4价,失去4个电子,因此每转移12mol电子,消耗3mol碳,质量是36g。
CO2↑+2SO2↑ + 2H2O;碳元素化合价从0价升高到+4价,失去4个电子,因此每转移12mol电子,消耗3mol碳,质量是36g。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下表是元素周期表的一部分。参照元素在表中的位置,请用化学用语回答下列问题:
族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ⑤ | ⑥ | ⑦ | |||||
3 | ② | ③ | ④ | ⑧ | ||||
4 | ⑨ | |||||||
5 | ⑩ |
(1)⑨的最高价含氧酸的化学式为_________。
(2)①和⑦两种元素的原子按1:1组成的常见化合物的结构式为_________。
(3)③④⑦⑧的简单离予半径由大到小的顺序为_________。(用离子符号表示)
(4)②④的最高价氧化物的水化物之间发生反应的离予方程式_________。
(5)用电子式表示③和⑨组成的化介物的形成过程_________。
(6)海带中含有⑩元素,海带灰中含有该元素的简单阴离子。在硫酸酸化下,可用双氧水将其氧化为单质。写出该反应的离子方程式_________。