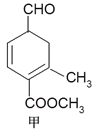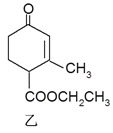题目内容
【题目】常温下,Ka1(H2C2O4)=10-1.3, Ka2(H2C2O4)=10-4.2。用0.1000 mol·L-1 NaOH溶液滴定10.00 mL 0.1000 mol·L-1 H2C2O4溶液所得滴定曲线如图。下列说法正确的是
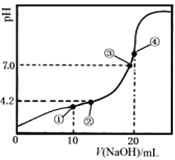
A. 点①所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
B. 点②所示溶液中:c(HC2O4-)=c(C2O42-)
C. 点③所示溶液中:c(Na+)=c(HC2O4-) + c(C2O42-)
D. 点④所示溶液中:c(Na+) + c(H2C2O4) + 2c(H+)=2c(OH-) + 2c(C2O42-)
【答案】B
【解析】点①反应后溶液是NaHC2O4溶液,溶液显酸性,说明HC2O4-的电离大于水解,因此c(Na+)>c(HC2O4-)>c(C2O42-) >c(H2C2O4),A错误;根据Ka2(H2C2O4)=10-4.2可知,Ka2(H2C2O4)= c(H+) c(C2O42-)/ c(HC2O4-)= 10-4.2,由图像可知,pH=4.2, c(H+)=10-4.2mol/L,所以c(HC2O4-)=c(C2O42-),B正确;点③![]() ,即
,即![]() ,由电荷守恒可知:c(Na+)+ c(H+)=c(HC2O4-) +2 c(C2O42-)+ c(OH-),所以c(Na+)=c(HC2O4-) +2 c(C2O42-),C错误;点④所示溶液溶质为Na2C2O4溶液,电荷守恒为c(Na+)+ c(H+)=c(HC2O4-) +2 c(C2O42-)+ c(OH-),物料守恒为:c(Na+)=2c(HC2O4-) + 2c(C2O42-)+2 c(H2C2O4),所以质子守恒:c(OH-)= c(H+)+c(HC2O4-)+2 c(H2C2O4),D选项不符合任何一个守恒关系,D错误;正确选项B。
,由电荷守恒可知:c(Na+)+ c(H+)=c(HC2O4-) +2 c(C2O42-)+ c(OH-),所以c(Na+)=c(HC2O4-) +2 c(C2O42-),C错误;点④所示溶液溶质为Na2C2O4溶液,电荷守恒为c(Na+)+ c(H+)=c(HC2O4-) +2 c(C2O42-)+ c(OH-),物料守恒为:c(Na+)=2c(HC2O4-) + 2c(C2O42-)+2 c(H2C2O4),所以质子守恒:c(OH-)= c(H+)+c(HC2O4-)+2 c(H2C2O4),D选项不符合任何一个守恒关系,D错误;正确选项B。
点睛;有关酸碱滴定反应的这类题目,要考虑到溶液中存在的电荷守恒、物料守恒、质子守恒规律,易于问题的快速突破和解决。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案